
7.下列各溶液中,pH最大的是
A.pH=9的氨水溶液稀释1000倍 B.pH=9的烧碱溶液稀释1000倍
C.pH=5的盐酸溶液稀释1000倍 D.pH=5的氯化铵溶液稀释1000倍
6.下列物质的制备,符合工业生产实际的是
A.将氯所通入澄清石灰水中制漂白粉
B.用离子交换膜法电解饱和食盐水制备烧碱、氢的和氯气
C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸
D.工业制硫酸在吸收塔中用水吸收SO3生成硫酸
29.(15分)铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。 “速力菲”是市场上一种常见的补铁药物,下表格是它的说明书。
|
[规格] 每片含琥珀酸亚铁0.1g [适应症] 用于缺铁性贫血症,预防及治疗用。 [用量用法] 成人预防量0.1g/日,成人治疗量0.2g-0.4g/日, 小儿用量预防量30-60mg/日,治疗量0.1g-0.3g/日。 [儲藏] 避光、密封、在干燥处保存 |
(1) 该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用。
① 为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 (填试剂的名称)。
② 实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应)。请配平下列离子方程式:
MnO4-+ Fe2+ + H+ == Mn2+ + Fe3+ + H2O
③ 称量上述含铁元素质量分数为20.00% 的“速力菲”10.00 g,将其全部溶于稀硫酸中,配制成1000.00 mL溶液,取出20.00 mL,用0.01 mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00 mL。该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)。
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含23.6 g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式) ,琥珀酸亚铁的化学式为 。
28.(15分) I.体积为5 L的恒温、恒容密闭容器甲起始投入2 mol N2 3 mol H2经过10s钟达平衡,测得平衡时NH3的物质的量为0.8 mol。
II.容器乙起始投入a mol N2,b mol H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2 mol。两平衡温度相同、相同组分的体积分数都相同。
(1)
容器甲10 s 内用H2表示的平均反应速率v(H2)
= _________________,达平衡时N2的转化率 = _______________。
= _______________。
(2) 下列哪些情况表明容器乙已达平衡状态?( )
A.容器乙的气体密度不再变化
B.氢元素的质量不再变化
C.氮气的生成速率等于氨气的消耗速率
D.断裂1 mol N≡N键同时断裂6 mol N-H键
(3)达平衡时甲容器的压强______乙容器的压强(填“等于”、“大于”或“小于”)。
(4) a = _______________mol,b = ______________mol。
(5)达平衡乙容器的体积为_____________L。
(6)起始时容器乙是容器甲压强的_______________倍。
27.(14分)常温时,溶液①为100 mL 0.2 mol/L NaClO溶液
溶液②为100 mL pH = 1 HNO3溶液
溶液③为溶液①和溶液②混合溶液,测其pH = 9。
(1) 溶液①显__________性(填“酸”、“中”或“碱”)。其原因是(用离子方程式表示)____________________________________________________________。溶液②中由水电离出来的H+浓度c(H+) = _______________mol/L。
(2) 溶液③中:
Ⅰ.c(ClO-)__________c(NO3-)(填“大于”、“小于”或“等于”)
Ⅱ.c(ClO-) + c(HClO) = _____________ mol/L。
Ⅲ.Na+、ClO-、NO3-、OH-、H+离子浓度由大到小的顺序是:___________。
26.(15分)短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2L H2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为 ,B和C形成的化合物电子式为 ;
(2)B和D简单离子的半径大小为 (用离子符号和“>”、“=”或“<”表示);
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号);
① 比较两种单质的颜色 ② 比较氢化物的稳定性 ③ 比较原子半径大小
④ 依据两元素在周期表的位置 ⑤ 比较最高价氧化物对应水合物的酸性
(4)E元素能与A元素形成共价化合物,分子中的原子个数比为1︰3,则该物质的结构式为 。
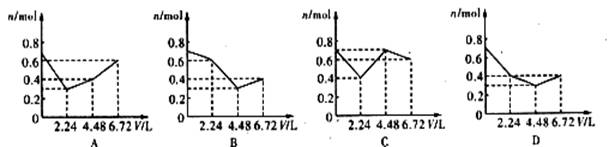
13.往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解忽略不计)
第II卷(60分)
12.下列各溶液中,微粒的物质的量浓度关系正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+) = c(NO3-)
B.1.0 mol·L-1Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+)
C.1.0 mol·L-1 NH4Cl溶液:c(NH4+) = c(Cl-)
D.醋酸钠溶液: c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
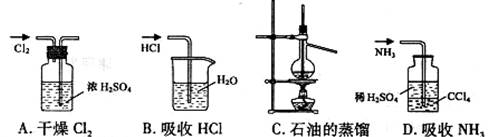
11.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
10.美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.原子半径:Na>Al
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al) < n(Na)
C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com