
18、(12分)(1)氨基(1分),酚羟基(1分)
(2)取代(2分)
(3)CH3CHO+2Cu(OH)2 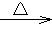 CH3COOH+Cu2O↓+2H2O(2分)
CH3COOH+Cu2O↓+2H2O(2分)
(4) 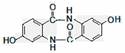 (2分)
(2分)
(5)(4分,其他合理答案也给分)
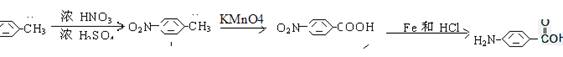
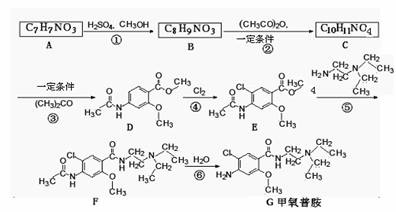
18.(12分)甲氧普胺(Metoclopramide)是一种消化系统促动力药。它的工业合成路线如下[已知氨基(-NH2)易被氧化剂氧化]:
请回答下列问题:
(1)已知A物质既能与酸反应又能与碱反应,长期暴露在空气中会变质。 A物质中所含有的官能团除羧基外还有 、 。
(2)反应④的反应类型为
(3)反应③的另一种有机产物与新制Cu(OH)2悬浊液反应的化学方程式为 。
(4)A物质的一种同分异构体H可以发生分子间缩合反应,形成一个含八元环的物质I,则I的结构简式为 ;(5)写出以甲苯为原料合成 ,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
已知:Ⅰ、当一取代苯进行取代反应时,新引进的取代基因受原取代基的影响而取代邻、对位或间位。使新取代基进入它的邻、对位的取代基:-CH3、-NH2 使新取代基进入它的间位的取代基:-COOH、-NO2;
Ⅱ、-NH2易被氧化;-NO2可被Fe和HCl还原成-NH2
例:由乙醇合成聚乙烯的反应流程图可表示为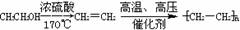

17.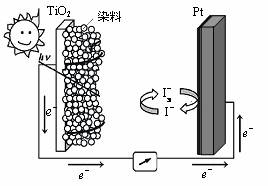 (8分)纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700-1000℃)进行水解,其化学反应式为: ▲ 。
(8分)纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700-1000℃)进行水解,其化学反应式为: ▲ 。
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ▲ ;通过质谱仪发现还有多种副反物,其中之一为: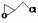 ,则该有机物核磁共振氢谱有 ▲ 个峰。
,则该有机物核磁共振氢谱有 ▲ 个峰。

 (3)利用半导材料TiO2与染料、铂电极及I
(3)利用半导材料TiO2与染料、铂电极及I 和I-的混合物作电解质(I2+I-
和I-的混合物作电解质(I2+I- I
I ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。
),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。
(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下。下列说法正确的是 ▲ 。
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同
16. (10分)钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
(10分)钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
(1)铁在元素周期表中位于 ▲ 周期 ▲ 族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有: ▲ (选用右图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是 ▲ 。(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
|
反应序号 |
化学反应 |
反应热 |
|
① |
Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) |
△H1=
-26.7kJ·mol-1 |
|
② |
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) |
△H2= -50.8kJ·mol-1 |
|
③ |
Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) |
△H3=
-36.5kJ·mol-1 |
|
④ |
FeO(s)+CO(g)=Fe(s)+CO2(g)
|
△H4 |
反应④△H4= ▲ kJ·mol-1。
(5)1100℃时, FeO(s)+CO(g)  Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:
14.(8分)以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下:
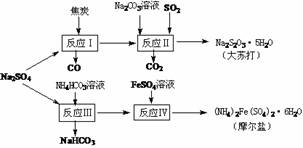 试回答下列问题:
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)= Na2S(s)+4CO(g)△H=+569.99 kJ/mol,欲使该反应发生并维持该反应进行的条件是 ▲ (a)常温 (b)常温,并通入少量CO2 (c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式: □Na2S+□Na2CO3+□SO2
=□Na2S2O3+□CO2
▲(3)反应Ⅲ温度需控制在35-40℃的较低温度,其主要原因是 。(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO 都大量减少,该物质是
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因: ▲ 。
都大量减少,该物质是
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因: ▲ 。
3.⑴ acd ⑵(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)
⑶ ①CO2+6H++6e-=CH3OH+H2O ②2240
(每空2分,共8分)
训练四
1(12分).由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合利用率高,废弃物少。
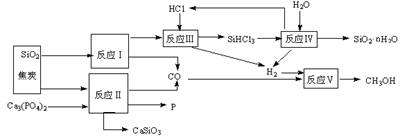 (1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是 ▲ 。
(3)高温下进行的反应Ⅱ的化学方程式为: ▲ ;固体废弃物CaSiO3可用于 ▲ 。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是 ▲ 。(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 ▲ 。
2(10分).钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用。但在较高温度下,钛可与多种单质和化合物发生反应。工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
①沸腾氯化炉中反应:TiO2(s) +2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =2.6 kJ/mol则TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = ▲ kJ/mol
③海绵钛破碎后用0.5%-1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的 ▲ 。
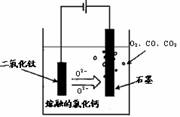 (2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为: ▲ 。②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体是 ▲ 。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为: ▲ 。②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体是 ▲ 。
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为: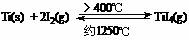 ,下列说法正确的是
▲ 。(a) 该反应正反应为的△H>0
(b) 在不同温度区域,TiI4 的量保持不变
,下列说法正确的是
▲ 。(a) 该反应正反应为的△H>0
(b) 在不同温度区域,TiI4 的量保持不变
(c) 在提纯过程中,I2 的量不断减少 (d) 在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
3(12分).雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:
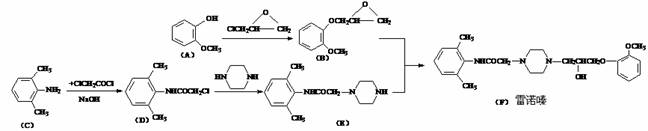
(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称: ▲ 、 ▲ 。
(2)写出满足下列条件A的同分异构体的数目 ▲ 。①A能与FeCl3溶液发生显色反应;②1molA可与2molNaOH反应。(3)C→D中,加入适量NaOH的作用是: ▲ 。(4)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。
已知:
 1
1
1(12分).
(1)Ⅰ、Ⅲ(2分) (2)分馏(蒸馏)(2分)
(3)Ca3(PO4)2+5C+3SiO2 3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
(4)SiHCl3会水解,同时产生的H2,与O2混合发生爆炸等(2分)
(5)CH3OH+H2O-6e-=CO2+6H+(2分)
2(10分).
(1)①不能(2分);②-970.2(2分);③除去其中的过量的钠并溶解氯化钠及钛的低价氯化物(1分)
(2)①TiO2 +4e- = Ti +O2-(或:Ca2++2e-=Ca ,2Ca+TiO2 = 2CaO +Ti)(2分)
②H2(1分)(3)d(2分)
3(12分).(1)羟基、醚键(2分,) (2)6 (2分)
(3)与取代产物HCl作用,使平衡向生成D的方向移动,提高D的产率(2分)。
(4)
(每空1分,共6分)
训练五
2.⑴CO2、CO的混合物 ⑶NH4++NO2- N2↑+2H2O
N2↑+2H2O
⑷步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。
②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
(每空2分,共12分)
1.⑴c
⑵①乙醛 ②酯化反应(或取代反应) NaOH醇溶液、加热
③n


⑶
 (第⑴、⑵两小题每空2分,第⑶小题4分,共12分)
(第⑴、⑵两小题每空2分,第⑶小题4分,共12分)
3.(8分)CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有___▲___(填字母)。
 a.减少化石燃料的使用,开发新能源b.使用无氟冰箱,减少氟里昂排放
a.减少化石燃料的使用,开发新能源b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 ▲ (只要求写一种)。
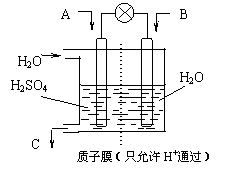
⑶有学者设想以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 ▲ 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 ▲ L/min(标准状况)。
2.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设 ①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 ▲ 。
⑵设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
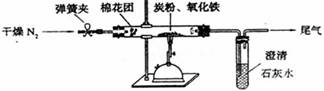 ⑶查阅资料
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: ▲ 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。步骤②、④中都分别通入N2,其作用分别为 ▲ 。
⑸数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: ▲ 。
⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 ▲ 。
②从环境保护的角度,请你再提出一个优化方案: ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com