
25、(10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):

某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
|
沉淀物 |
CuS |
ZnS |
MnS |
FeS |
|
|
|
Ksp |
8.5×10-45 |
1.2×10-23 |
1.4×10-15 |
3.7×10-14 |
|
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为:
。
(2)滤渣A的主要成分为 。(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为 。
(5)从废旧碱性锌锰电池中可回收利用的物质有 (写两种)
24、(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请在右边方框内画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 负极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
23、(8分)⑴现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 。纯碱溶液呈碱性的原因(用离子方程式表示)是 ,该溶液pH的范围一定介于 之间。
⑵为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
22、(4分)某无色透明的水溶液中仅含有NH4+、Cl-等四种离子,请回答以下问题:
(1)该溶液中所含的离子除NH4+、Cl-外,还应有 __ 两种离子
(2)若该溶液的pH=7,则该溶液中的溶质包括(写化学式)
21、(8分)试回答下列问题(温度均为25℃时):
(1)0.01 mol/L的稀盐酸pH= ,其中由水电离出的c(H+)水= mol/L;
(2)1
mL pH=12的NaOH溶液,加水稀释至100 mL,稀释后的溶液中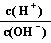 =
;
=
;
(3)pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合。若所得混合溶液呈中性,则a :b=
20、一种一元强酸HA溶液中加入一种MOH反应后,溶液呈中性,下列判断正确的是( )
A.加入的碱过量 B.混合前酸与碱中溶质的物质的量相等
C.生成的盐不发生水解 D.反应后溶液中的A-、M+物质的量浓度相等
非选择题(共50分)
19、 常温下,物质的量浓度相同、体积也相同的下列各组物质混合后能使pH大于7的是( )
A.NaHCO3、HCl、KCl B.NaHSO4、H2SO4、NaCl
C.K2S、KCl、HCl D.K2CO3、HCl、NaHSO4
18、下列各组比值中,等于1:3的是( )
①硝酸铁溶液中,c(Fe3+):c(NO3-)②pH=1的盐酸跟pH=3的盐酸的物质的量浓度之比 ③0.1mol/L醋酸跟0.3mol/L醋酸溶液中氢离子浓度之比 ④0.1mol/L的醋酸钠跟0.3mol/L的氯化钠溶液中的Na+离子浓度之比
A ①② B ①②③ C ③④ D 只有④
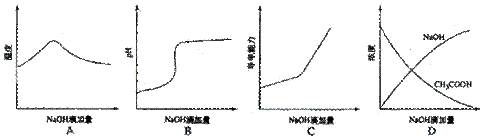
17、将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
15、用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,
已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( )
A.c(H+)>C(OH-)
B.c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.2 mol·L-1
16、下列关系的表述中,正确的是( )
A.0.1mol·L-1NaHSO4溶液中:c(Na+)+ c(H+)= c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com