
3.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+  ΔH=-226 kJ/mol
ΔH=-226 kJ/mol

以上热化学方程式判断,下列说法正确的是 (
.CO的燃烧热为283 kJ
.右图可表示由CO生成CO2的反应过程和能量关系
.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
2.红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1 mol产物的数据)

根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
1.在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
|
|

反应过程
(1)该反应是 (填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为 。
2.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。
热化学方程式书写和反应能量变化图
1.根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(1)NH4HCO3分解 反应速率降低 水浴加热
6.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 A
Cd(OH)2 + 2Ni(OH)2 A
有关该电池的说法正确的是 ( )
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
溶解平衡应用
5. 某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应为:
某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应为:
|
( )
A.放电时负极反应为:Zn-2e–+2OH–=Zn(OH)2
B.放电时正极反应为: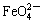 +4H2O+3e–=Fe(OH)3+5OH–
C.放电时每转移3 mol电子,正极有1 molK2FeO4被氧化
D.充电时阳极附近溶液的碱性减弱
+4H2O+3e–=Fe(OH)3+5OH–
C.放电时每转移3 mol电子,正极有1 molK2FeO4被氧化
D.充电时阳极附近溶液的碱性减弱
4.工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝。已知电极材料为惰性材料,阳极反应式为______________________________。
3.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
|
|
 NiOOH + MH
NiOOH + MH
下列叙述正确的是 ( )
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M + H2O +e-=MH + OH-
C.充电时阳极反应为:NiOOH+ H2O +e-=Ni(OH)2 + OH-
D.放电时每转移1mol电子,正极有1mol NiOOH 被氧化
2.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B. 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com