
28.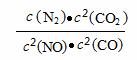 (10分)(1)
(2分)
(10分)(1)
(2分)
(2)-746 (2分) (3)③④(全对得2分,漏选得1分,有错选得0分)
(4)②③(全对得2分,漏选得1分,有错选得0分)
(5)0.05 (2分)




27. (16分)
(1)①图2 (2分) ② Cu + 4H+ +2NO3- = Cu2+ + 2NO2↑+ 2H2O (2分)
③ 催化剂(2分) ④ 瓶口向上排空气法 (2分)
(2)① 有利于控制氧气气流的速度(控制氧气的量)(2分)
②将胶头滴管中的水挤压进烧瓶,然后打开止水夹,可以看到烧杯中的水进入烧瓶形成喷泉(2分)
③4:1 (2分) 0.036 (2分)
26. (16分)
(1)Na > Cl > F (全对2分) (2)HClO4 > H2SO4 (两空全对得2分,有错得0分))

(3) H2O2 +2 Fe2++2H+= 2Fe3+ +2H2O(全对2分)
(4)① 2Al + 2NaOH + 2H2O = 2NaAlO2 +3H2↑(2分,缺↑不扣分)
②取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成(全对2分)
③0.01 (2分) ④Al (OH)3 H2O、NaCl(全对给2分,答对Al (OH)3 给1分,出现其他非正答物质得0分)
25.(16分,每空2分)
(1)a b c (全对得2分,漏选得1分,有错选得0分)
(2)醛基 在试管里加入10%的氢氧化钠溶液,2mL,滴加2%的硫酸铜铜溶液4-6滴,得到新制的氢氧化铜,振荡后加入A的溶液0.5mL,加热,得到红色沉淀。(或在新制的银氨溶液中滴加A的溶液,振荡后将试管放在热水浴中温热,产生银镜。)
 (3)①②⑤(全对得2分,漏选得1分,有错选得0分)
(3)①②⑤(全对得2分,漏选得1分,有错选得0分)
(4)
(全对得2分,缺少条件或条件不对其他正确得1分)

(5)
(全对得2分,缺少条件或条件不对其他正确得1分)
(6) (7)蒸馏
6.C 7.C 8.D 9.D 10.B 11.A 12.B
非选择题
28. (10分)汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,其中发生如下反应:2NO+2CO
N2 + 2CO2。
(10分)汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,其中发生如下反应:2NO+2CO
N2 + 2CO2。
 (1)2 NO(g)+2 CO(g) N2(g) + 2 CO2(g)反应的平衡常数的表达式为:K = 。
(1)2 NO(g)+2 CO(g) N2(g) + 2 CO2(g)反应的平衡常数的表达式为:K = 。
(2)已知: CO(g)+1/2 O2(g) = 2CO2(g) △H = -283 kJ/mol
N2(g)+ O2(g) = 2 NO(g) △H = +180 kJ/mol
 则反应2
NO(g)+2 CO(g) N2(g) + 2 CO2(g) △H =
kJ/mol。
则反应2
NO(g)+2 CO(g) N2(g) + 2 CO2(g) △H =
kJ/mol。
 (3)对于可逆反应2 NO(g)+2
CO(g) N2(g)
+ 2 CO2(g),结合(2)中信息,下列说法正确的是 。
(3)对于可逆反应2 NO(g)+2
CO(g) N2(g)
+ 2 CO2(g),结合(2)中信息,下列说法正确的是 。
① 升高温度,平衡常数增大
② 升高温度,逆反应速率降低
③ 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
 ④ 反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2
和CO2的方向移动
④ 反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2
和CO2的方向移动
(4)下列说法正确的是 。
① NO、CO、CO2均为酸性氧化物
② CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24 L CO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为 mol。
2009--2010年丰台区高三化学二模试题
选择题:
27.(16分)为探究如何尽可能多的使NO2被水吸收,某活动小组设计并完成了以下实验。
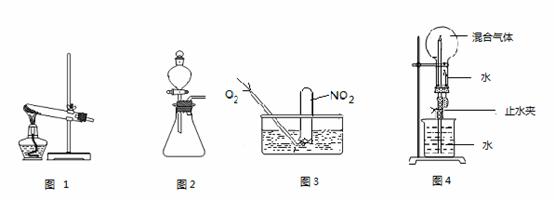
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
① 根据反应原理他们选用了相同的装置 (填“图 1”或“图 2”)分别制取NO2 和O2。
② 写出铜与浓硝酸反应的离子方程式 。
③过氧化氢溶液与MnO2制取O2时,MnO2的作用是 。
④ 收集NO2可采用的收集方法是 。
(2)活动小组的同学做了如下准备:用气囊收集好纯净的O2;收集了一试管NO2;用干燥的烧瓶收集了一定比例的NO2和O2混合气体。
① 为了尽可能多的使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通入O2相比,其优点是 。
② 利用图4吸收气体时,其操作和现象为 。
③ NO2、O2、H2O反应的产物为硝酸,反应中NO2和O2物质的量之比a:b = ;标准状况下,若图4中混合气体NO2和O2比例为a:b,当混合气体全部被吸收时所得溶液物质的量浓度为 mol/L(保留两位有效数字)。
26.(16分)下表为元素周期表的一部分,参照元素①-⑦在表中的位置,请用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
|
|
② |
④ |
|
|
3 |
⑤ |
|
③ |
|
|
⑥ |
⑦ |
|
(1)④、⑤、⑦的原子半径由大到小的顺序为___________。
(2)⑥和⑦的最高价含氧酸的酸性强弱为__ ___>_______。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为__________。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式____________。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

① 写出D溶液与G反应的化学方程式____________。
② 写出检验A溶液中溶质的阴离子的方法: ____________。
③ 常温下,若电解1 L 0.1 mol/L A溶液,一段时间 后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为__________ mol。
④ 若上图中各步反应均为完全转化,则混合物X中含有的物质有_______。
25.(16分)
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→G,G→麻黄碱的反应条件和部分反应物):
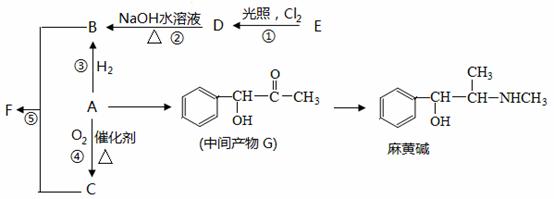
请回答下列问题:
(1)关于麻黄碱下列说法正确的是 (填字母)。
a. 麻黄碱的分子式为C10H15NO
b. 具有止咳平喘作用,是从中药麻黄中提取的生物碱
c. 属于国际奥委会严格禁止的兴奋剂
d. 麻黄碱属于芳香烃
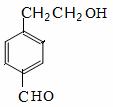
(2)有机物A的相对分子质量为106,A中含碳、氢、氧三种元素的质量分数之比为42:3:8,则A的含氧官能团名称是 ;检验该官能团的方法是 。
(3)反应①-⑤中属于取代反应的是 (填序号)。
(4)写出D→B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
① 与中间产物G 互为同分异构体
② 既能发生消去反应,又能发生酯化反应
③ 苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
|
|
溶解性 |
沸点 |
|
A |
微溶于水 |
179.0℃ |
|
E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的合理方法是 。
12.下列说法中不正确的是
A.将纯水加热至较高温度,水的离子积变大,pH减小,呈中性
B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+) > c(H+)
C.相同温度下,pH = 2的醋酸溶液与pH = 2的盐酸中c(H+)之比为1:1
D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com