
29.(15分)碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电 池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和
池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和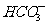 )为电解质,以具有催化作用和导电性能的稀土金属为电极。
)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4 =5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持
=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持 稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
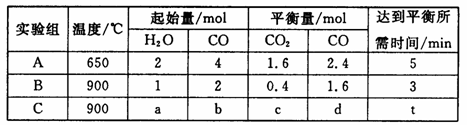
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
28.(15分)A、B、C、D、E为五种短周期元素,其中A、B、C位于同一周期,A元素的气态氢化物是一种广泛应用的优质气体燃料,B元素的氢化物是用途最为广泛的溶剂。B元素可分别与A、C、D、E组成RB2型化合物。已知在DB2中,D与B的质量比为
7 :8;在EB2中,E与B的质量比为1 :1。根据以上条件回答下列问题:
(1)请写出C单质分子的电子式______________;DB2晶体中化学键的类型为_____________;写出AE2的结构式 ___________________。
(2)C的气 态氢化物易液化,原因是___________________。
态氢化物易液化,原因是___________________。
(3)C和D结合可生成一种超硬物质,有关该物质性质的叙述中不正确的是______________________.
①有润滑性 ②易磨损 ③抗腐蚀 ④强还原性 ⑤抗冷热
(4)B元素可分别与A、E形成多种由两种元素构成的阴离子。某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再缓慢加入足量的稀硝酸,白色沉淀质量减少。由此得出的结论是_______________________。
(5)E元素的一种氧化物可与过氧化钠及氯水发生氧化还原反应。该氧化物与过氧化钠反应的化学方程式为_______________________;该氧化物与氯水反应的离子方程式为____________________________。
27.(15分)某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
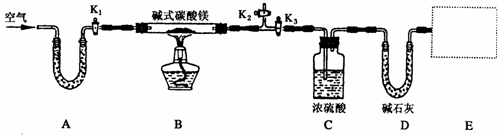
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K 1,再缓缓鼓入空气数分钟,其目的是_____________________。
1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
26.(21分)如图甲所示,在空心三棱柱CDF以外足够大的空间中,充满着磁感应强度为B的匀强磁场。三棱柱的轴线与磁场平行,截面边长为L,三棱柱用绝缘薄板材料制成,其内部有平行于CD侧面的金属板P、Q,两金属板间的距离为d,P板带正电,Q板带负电,Q板中心有一小孔,P板上与小孔正对的位置有一个粒子源S,从S处可以发出初速度为0、带电量为+q、质量为m的粒子,这些粒子与三棱柱侧面碰撞时无能量损失。试求:
(1)为使从S点发出的粒子最终又回到S点,P、Q之间的电压U应满足什么条件?(Q与CD之间距离不计)
(2)粒子从S点出发又回到S点的最短时间是多少?
(3)若磁场是半径为a的圆柱形区域,如图乙所示,圆柱的轴线与三棱柱的轴线重合,且a=( +
+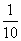 )L,要使S点发出的粒子最终又回到S点,则P、Q之间的电压不能超过多少?
)L,要使S点发出的粒子最终又回到S点,则P、Q之间的电压不能超过多少?

25.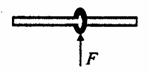 (18分)如图所示,一个质量为m的钢性圆环套在一根固定的足够长的水平直杆上,环的半径略大于杆的半径。环与杆之间的动摩擦因数为
(18分)如图所示,一个质量为m的钢性圆环套在一根固定的足够长的水平直杆上,环的半径略大于杆的半径。环与杆之间的动摩擦因数为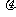 ,t=0时刻给环一个向右的初速度v0,同时对环施加一个方向始终竖直向上的力F,已知力F的大小F=kv(k为常数,v为环的运动速度),且有kv0>mg。t=t1时刻环开始沿杆做匀速直线运动,试求:
,t=0时刻给环一个向右的初速度v0,同时对环施加一个方向始终竖直向上的力F,已知力F的大小F=kv(k为常数,v为环的运动速度),且有kv0>mg。t=t1时刻环开始沿杆做匀速直线运动,试求:
(1)t=0时刻环的加速度;
(2)全过程中环克服摩擦力做的功;
(3)0-t1时间内环沿杆运动的距离。
24.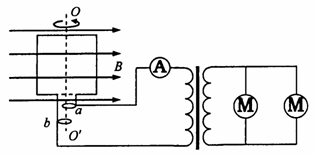 (15分)交流发电机的发电原理是矩形线圈在匀强磁场中绕垂直于磁场的轴OO′匀速转动。一小型发电机的线圈共220匝,线圈面积S=0.05 m2,线圈转动的频率为50 Hz,线圈内阻不计,磁场的磁感应强度B=
(15分)交流发电机的发电原理是矩形线圈在匀强磁场中绕垂直于磁场的轴OO′匀速转动。一小型发电机的线圈共220匝,线圈面积S=0.05 m2,线圈转动的频率为50 Hz,线圈内阻不计,磁场的磁感应强度B=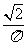 T。为了用此发电机发出的交流电带动两个标有“220 V 11 kW”的电动机正常工作,需在发电机的输出端a、b与电动机之间接一个理想变压器,电路如图所示。求:
T。为了用此发电机发出的交流电带动两个标有“220 V 11 kW”的电动机正常工作,需在发电机的输出端a、b与电动机之间接一个理想变压器,电路如图所示。求:
(1)发电机的输出电压;
(2)变压器原、副线圈的匝数比;
(3)与变压器原线圈串联的交流电流表的示数。
23.(10分)为了测定某迭层电池的电动势(约20V-22V)和内电阻(小于2 Ω),需要把一个量程为10V的直流电压表V(内阻为10 kΩ)接一固定电阻(用电阻箱
Ω),需要把一个量程为10V的直流电压表V(内阻为10 kΩ)接一固定电阻(用电阻箱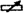 代替),改装成量程为30 V的电压表,然后用伏安法测电源的电动势和内电阻。
代替),改装成量程为30 V的电压表,然后用伏安法测电源的电动势和内电阻。
(1)进行改装时,与电压表V串联的电阻箱的阻值为__________kΩ。
(2)用图甲测量迭层电池的电动势E和内电阻r,图中虚线部分就是改装后的电压表
(其中V的表盘刻度没有更换),根据实验数据作出如图乙所示的U-I图线,可知电池的电动势为___________V,内电阻为__________Ω。(保留三位有效数字)

22.(8分)在测量弹簧劲度系数的实验中,先将弹簧水平放置测出其自然长度,然后竖直悬挂让其自然下垂,在其下端悬挂钩码,实验过程是在弹簧的弹性限度内进行的,作出所挂钩码的重力F与弹簧的形变量x的关系如图所示,由图可得出弹簧的劲度系数为________N/m;图线不过原点的原因是________________,图线不过原点对实验结果有无影响?__________________
21. 如图所示,一轻杆两端分别固定a、b 两个半径相等的光滑金属球,a球质量大于b球质量。整个装置放在光滑的水平面上,将此装置从图示位置由静止释放,则A.在b球落地前瞬间,a球的速度方向向右
如图所示,一轻杆两端分别固定a、b 两个半径相等的光滑金属球,a球质量大于b球质量。整个装置放在光滑的水平面上,将此装置从图示位置由静止释放,则A.在b球落地前瞬间,a球的速度方向向右
B.在b球落地前瞬间,a球的速度方向向左
C.在b球落地前的整个过程中,轻杆对b球的冲量为零
D.在b球落地前的整个过程中,轻杆对b球做的功为零
 第Ⅱ卷(非选择题 共
第Ⅱ卷(非选择题 共 174分)
174分)
20.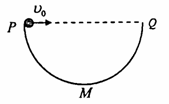 如图所示,一个半径为R的半圆环PMQ竖直放置并保持圆环直径PQ水平,M为环上的最低点。一个小球从P点以速度v0水平弹出,不计空气阻力。则下列判断正确的是
如图所示,一个半径为R的半圆环PMQ竖直放置并保持圆环直径PQ水平,M为环上的最低点。一个小球从P点以速度v0水平弹出,不计空气阻力。则下列判断正确的是
A.总可以找到一个v0值,使小球垂直撞击半圆环的PM段
B.总可以找到一个v0值,使小球垂直撞击半圆环的QM段
C.无论v0取何值,小球都不可能垂直撞击半圆环
D.无论v0取何值,小球都能垂直撞击半圆环
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com