
28.(16分)实验室制取氨与氨的有关性质实验会用到如下甲、乙、丙、丁四套装置:

(1)实验室通常利用图甲所示的装置来制取氨。简述点燃酒精灯后给试管加热的操作过程__________________________________________,说明发生装置试管口略向下倾斜的原因________________________________;
(2)图乙点滴板(或玻璃片)的3个凹穴中分别滴入1滴浓盐酸、浓硝酸和浓硫酸。然后加热NH4Cl和Ca(OH)2的混合物,当有氨放出时,移动点滴板,使导管口对准不同的酸。简述观察到的主要现象___________________________________________;
(3)实验室利用图丙所示的装置也可制取氨,指出所用的药品为__________________,利用相关化学原理解释产生氨的理由__________________________________________;
(4)某学生欲用图丁装置进行喷泉实验,结果失败,试分析失败的可能原因(填至少3个要点)________________________________________________________;
(5)若某学生用图丁装置成功进行了喷泉实验,已知烧瓶中用排空气法收集到的氨气(标准状况下)相对H2的密度为9,则理论上得到氨水的物质的量浓度约为_______mol/L.
27.(15分)A、B、C、D是中学化学常见单质,其中C、D是金属,构成它们的元素的原子序数分别为a、b、c、d,且2(a+b)=3(c-a);X、Y、Z、M、N、W、H、K是常见化合物,M为白色沉淀,它们之间有如下转化关系(图中反应物和生成物中的H2O已略去)

回答下列问题:
(1)写出M的化学式____________________;
(2)指出元素D在元素周期表中的位置________________________;
(3)C、D与Y的浓溶液能形成原电池,写出负极的电极反应式_____________________________;
(4)写出反应③的离子方程式____________________________________________;
(5)25时,pH=5的W和N的水溶液中,由水电离出来的c(H+)浓度之比为_____________。
26.(15分)
已知甲、乙、丙、丁、戊五种微粒为短周期元素形成的粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核分子,可与水发生置换反应,写出其化学方程式__________________________;
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,写出该反应的离子方程式________________________________;
(3)丙为含两种元素的分子,且原子个数比为1:1,其水溶液呈弱酸性,写出其主要的电离方程式________________________________;
(4)丁为六原子分子,人误饮少量丁能使人眼睛失明,写出丁的电子式______________;
(5)戊属于烃,已知1g戊在空气中完全燃烧放出52kJ的热量,写出戊的燃烧的热化学方程式_________________________________________。
13.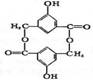 一环酯化合物结构简式如图,下列说法符合实际的是
一环酯化合物结构简式如图,下列说法符合实际的是
A.其水解产物能使FeCl3溶液变色
B.该化合物所有的原子都在同一平面上
C.与NaOH溶液反应时,1mol该化合物能消耗6mol NaOH
D.化学式为C16H10O6
第II卷(60分)
12. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol CuO,恰好恢复到电解前的浓度和pH。则电解过程中共转移电子的总物质的量为
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
11. 在一接近中性的含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是( )
A. NH4+、Br-、CO32- B. NH4+、I-、SO32-
C. Fe2+、I-、SO32- D. Fe2+、CO32-、I-
10.实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是

A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
9.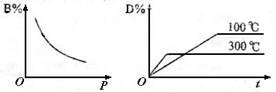 在一密闭容器里进行下列反应A(g)+B(g)
在一密闭容器里进行下列反应A(g)+B(g)  2C+D(g)此反应符合下列两个图象,则此反应符
2C+D(g)此反应符合下列两个图象,则此反应符
A.正反应为吸热反应,C是固体
B.正反应为吸热反应,C是气体
C.正反应为放热反应,C是气体
D.正反应为放热反应,C是固体或液体
8. F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是
A.XeF2分子中各原子均达到八电子结构
B.上述反应中只有XeO3分子为氧化产物
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
7. 下列有关叙述中,正确的是
A. 氧元素的相对原子质量为16.00,故氧原子核内的质子数和中子数均是8
B. 等物质的量的CH5+离子和NH4+离子中所含有的质子数相等
C. 白磷分子的摩尔质量为31
D. NaOH中既含有离子键又含有非极性键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com