
32.C 33.B 34. C 35.B
24.C 25.D 26.D 27.A 28.C 29. B 30.B 31.A
22.(13分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题;
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)E元素原子形成简单阴离子的结构示意图: ;
(5)用氢键表示式写出E的氢化物水溶液中存在的所有氢键:
20.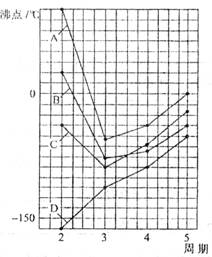 (8分)下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素的气态氢化物沸点的是曲线
,表示ⅣA族元素的气态氢化物沸点的是曲线
;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是
(8分)下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素的气态氢化物沸点的是曲线
,表示ⅣA族元素的气态氢化物沸点的是曲线
;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是
;
曲线中第2周期元素的气态氢化物沸点显著高于第3周期元素的气态氢化物沸点,其原因是
2l.(8分)A、B、C、D、E为5种由短周期元素构成 的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
A |
B |
C |
D |
E |
|
原子核数 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数 |
1- |
0 |
2+ |
1+ |
0 |
其中:B是由极性键构成的4原子分子,A和D可以形成B和E。
(1)A、C、E的化学式是:A ,C ,E 。
(2)室温下,等物质的量的B与HCl反应所得产物的水溶液pH 7(填“<”、
“>”或“等”),原因是(用离子方程式表示): 。
(3)已知B和E分子中存在着氢键,请写出另一种同样含有氢键的微粒,而且要求该
微粒是分子且核外共含有10电子: 。
19.(12分)原子结构与元素周期表存在着内在联系。根据已学原子结构知识,请你回答下列问题:
(1)具有(n-1)d10ns2电子构型的元素位于周期表 族。
(2)铁元素在周期表中的位置是 ;
其原子核外电子排布式为 。
(3)N层的s能级和p能级只有一个不成对电子的元素有多种。其中第一电离能最小的是 (填元素符号,下同);电负性最大的元素是 ;外围电子排布为3d104s1的元素是 。
18.(10分)有下列六种物质:NaOH、Na2S、NH4Cl、Na2O2、C2H2、H2O2
请按要求完成下列填空(填化学式):
(1)只含有离子键的是
(2)含有配位键的是
(3)既含有离子键又含有非极性共价键的是
(4)含有极性共价键的非极性分子是
(5)含有非极性共价键的极性分子是
17.(9分)根据要求作答:
(1)以下是一些基态原子的2p能级和3d能级中电子排的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。

违反泡利不相容原理的有 (填序号,下同),违反洪特规则的有 。
(2)氯化铝是共价化合物,其气态分子为二聚体(AlCl3)2,其结构式为
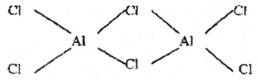
在你认为是配位键的短线上直接加上箭头符号。
(3)指出PCl3中心原子采取的杂化轨道类型 ,分子的几何构型
为 分子的极性为
16. X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z元素的原子3s、3p能级上电子数相等,W可形成自然界中最硬的物质。下列叙述中错误的是
A.Z和W两元素的原子都可与X的原子构成正四面体结构的分子
B.Y和W的原子可构成非极性分子WY2,也可构成极性分子WY
C.四种元素中Y的电负性最大
D.X2Y和X2Y2都是只含极性键的极性分子
普通高中阶段性模块练习题
高二化学(物质结构与性质)
第Ⅱ卷(非选择题共60分)
15.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解时,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后深蓝色的透明溶液中加入盐酸,溶液中又会生成蓝色沉淀
D.在[Cu(NH3)4]2+离子中,Cu2+提供孤对电予,NH3提供空轨道
13.下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为1S2的X原子与原子核外电子排布式为1S2 2S2的Y原子
B.2P轨道上有一个未成时电子的X原子与3P轨道上有一个未成对电子的Y原子
C.价电子构型为3 S2 3P5的x原子与价电子构型为4S2 4P5的Y原子
D.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 14.已知短周期元素的离子aA2+、bB+、cC3-、dD一都具有相同的电子层结构,则下列叙述正确
的是
A.原子半径A>B>D>C B.离子半径C>D>B>A
C.原予序数d>c>b>a D.单质的还原性A>B>D>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com