
解析:本题关注生态环境方面,以引发东海赤潮的东海原甲藻作为实验材料,通过分析温度与pH等环境因素对其光合作用的影响,从而在一定程度上认识东海赤潮发生的机理。
答案:(1)CO2 (2)原设定的PH值(起始PH值) 自
(3)不能 因为长时间处于PH10.0的条件下,甲藻的净光合作用速率为负值,甲藻不能生长繁殖。
(4)富营养化(N、P含量 或 矿质元素含量)

将生长旺盛的甲藻等量分成5组培养,各组藻液pH分别设定为6.0、7.0、8.0、9.O、10.0,在黑暗中放置12 h,然后在适宜光照等相同条件下培养,随即多次涮定各组氧气释放量并计算净光合速率。将实验结果绘制成右图。
(1)本实验除了通过测定氧气释放量,还可以通过测定 吸收量来计算净光合速率。
(2)黑暗放置过程中,藻液pH会有所变化.因此在测定氧气释放量前.需多次将各组pH分别调到 ,这是控制实验的
变量。
(3)若甲藻{圭时间处于pH10.0条件下,甲藻 (能、不能)正常生长繁殖,请据图分析并说明原因:
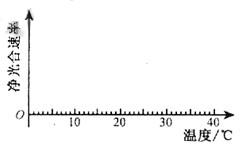 。
。
(4)实验表明,甲藻光合作用适宜pH6.0-9.0。但海水在该pH条件下,一般不会发生赤潮,原因是生赤潮除了与pH、温度、光照强度等因素有关外,最主要还与海水的 有关。
29.(14)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,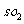 与空气反应t min后,
与空气反应t min后,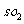 和
和 物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为 _________mol/L ;生成SO3的化学反应速率为__________mol/(L • min)。
物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为 _________mol/L ;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制制硫酸,尾气SO2用_______吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示

29题图
①当左槽溶液逐渐由黄变蓝,其电极反应式为__________.
②充电过程中,右槽溶液颜色逐渐由__________色变为_______色。
③放电过程中氢离子的作用是______和_______;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为________.
2010年普通高等学校招生全国统一考试(重庆卷)
28.(16分)阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到E和R两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备

① A可由人类重要的营养物质________水解制得(填“糖类”、“油脂”或“蛋白质”).
② B与新制的Cu(OH)2反应生成D,其化学方程式为______________.
③ D经加聚反应生成E,E的结构简式为______________.
(2)阻垢剂R的制备

① 
 为取代反映,J的结构简式为__________________.
为取代反映,J的结构简式为__________________.
② J转化为L的过程中,L分子中增加的碳原子来源于 __________________ 。
③ 由L制备M的反应步骤依次为:
 、_____、_____(用化学方程式表示)
、_____、_____(用化学方程式表示)
④ 1 molQ的同分异构体T(碳链无支链)与足量NaHCO3溶液作用产生2molCO2,T的结构简式为___________(只写一种)。
27.(15分)某兴趣小组用题27图装置探究氨的催化氧化。

27题图
(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,积压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
26.(15分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)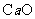 .
.
(1) 元素在周期表中位置是___,其原子结构示意图___.
元素在周期表中位置是___,其原子结构示意图___.
(2) 与最活跃的非金属元素A形成化合物D,D的电子式为___,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为___,D的沸点比A与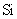 形成的化合物E的沸点___.
形成的化合物E的沸点___.
(3)配平用钙线氧脱鳞的化学方程式:

(4)将钙线试样溶于稀盐酸后,加入过量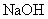 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色 .则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
.则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
(5)取1.6g钙线试样,与水充分反映,生成224ml. (标准状况),再向溶液中通入适量的
(标准状况),再向溶液中通入适量的 ,最多能得到
,最多能得到 g.
g.
13.pH=2的两种一元酸x和y,体积均为100ml,稀释过程中pH与溶液体积的关系如图13所示。分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液体积为Vx,Vy,则
A.x为弱酸,Vx<Vy B. x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D. y为强酸,Vx>Vy
12.已知H2(g)+Br2(l)=2HBr(g);△H=-72KJ/mol,蒸发1mol Br2(l)需要吸收的能量为30KJ,其他的相关数据如下表:

 则表中a为
则表中a为
A.404 B.260 C.230 D.200
11. 贝诺酯是由阿司匹林,扑热息痛经化学法并合制备的解热镇痛抗炎药,具合成反应式(反应条件略去)如下:
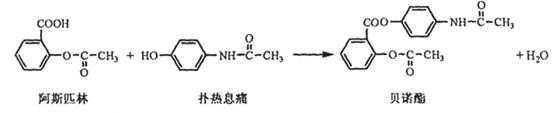
下列叙述错误的是
A. FeCl3 溶液可区别阿司匹林和扑热息痛
B. 1mol阿司匹林最多可消耗2mol NaOH
C. 常温下贝诺酯在水中的溶解度小于扑热息痛
D. C6H7NO 是扑热息痛发生类似酯水解反应的产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com