
14. 在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知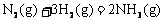
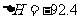 kJ·mol
kJ·mol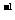 )
)
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L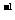 ) ) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
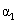 |
 |
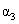 |
下列说法正确的是
A.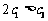 B.
B.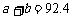 C.
C.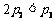 D.
D.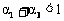

非选择题
13. 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE古有相同类型的化学键
12.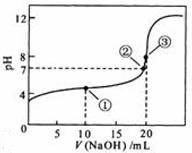 常温下,用 0.1000 mol·L
常温下,用 0.1000 mol·L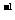 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L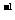
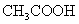 溶液所得滴定曲线如右图。下列说法正确的是
溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:
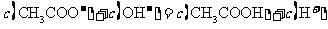
B.点②所示溶液中:
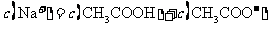
C.点③所示溶液中:
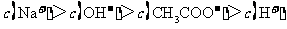
D.滴定过程中可能出现:
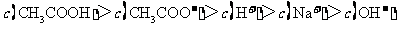
11. 右图是一种航天器能量储存系统原理示意图。
右图是一种航天器能量储存系统原理示意图。
下列说法正确的是
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:
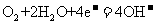
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
[答案]C
[解析]本题主要考查的是电化学知识。A项,在该装置系统中,有四种能量转化的关系,即太阳能、电能、化学能和机械能之间的相互转化;B项,装置Y为氢氧燃料电池,负极电极反应为H2 -2e- + 2OH- = 2H2O;C项,相当于用光能电解水,产生H2和O2,实现燃料(H2)和氧化剂(O2)的再生;D项,在反应过程中,有能力的损耗和热效应的产生,不可能实现化学能和电能的完全转化。综上分析可知,本题选C项。
10. 下列实验操作与预期实验目的或所得实验结论一致的是
下列实验操作与预期实验目的或所得实验结论一致的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是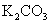 |
|
B |
向含有少量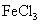 的 的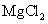 溶液中加入足量 溶液中加入足量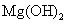 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去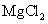 溶液中少量 溶液中少量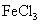 |
|
C |
常温下,向饱和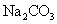 溶液中加少量 溶液中加少量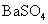 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下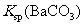 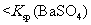 |
|
D |
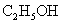 与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性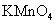 溶液 溶液 |
检验制得气体是否为乙烯 |
[答案]B
[解析]本题主要考查的是实验基本操作。A项,与盐酸反应产生CO2气体的不一定是CO32-,也有可能是HCO3-;B项,加入Mg(OH)2、MgO等物质能促使Fe3+的水解转化为沉淀而除去FeCl3,同时也不会引进新杂质;C项,根据现象,说明沉淀中有BaCO3,说明Ksp(BaCO3)>Ksp(BaSO4);D项,在此实验中,还有可能有副反应产生的SO2也能是高锰酸钾溶液褪色。综上分析可知,本题选B项。
[备考提示]溶度积Ksp反映了难溶电解质在水中的溶解能力,对于阴、阳离子个数比相同的物质来讲,Ksp的数值越小说明相应离子在水中越容易生成沉淀。
9. 阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
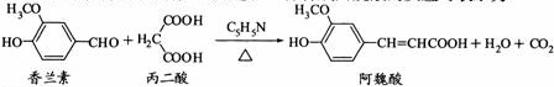
下列说法正确的是
A.可用酸性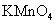 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与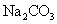 、
、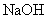 溶液反应
溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
8.下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应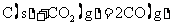 不能自发进行,则该反应的
不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中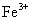 、
、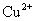 、
、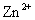 的氧化性依次减弱
的氧化性依次减弱
7.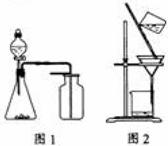 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是
A.选择合适的试剂,用图1所示装置可分别制取少量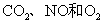
B.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用广泛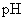 试纸测得0.10mol·L
试纸测得0.10mol·L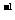 NH4Cl溶液的
NH4Cl溶液的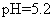

不定项选择题:本题包括7小题,每小题4分,共计28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
6. 常温下,下列各组离子在指定溶液中能大量共存的是
常温下,下列各组离子在指定溶液中能大量共存的是
A.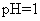 的溶液中:
的溶液中: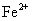 、
、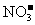 、
、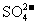 、
、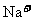
B.由水电离的 的溶液中:
的溶液中: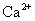 、
、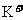 、
、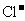 、
、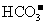
C.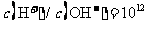 的溶液中:
的溶液中: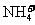 、
、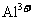 、
、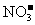 、
、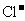
D.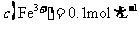 的溶液中:
的溶液中: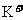 、
、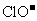 、
、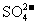 、
、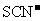
[答案]C
[解析]本题主要考查的是离子共存问题。A项,由于H+、NO3-与Fe2+发生氧化还原反应而不能大量共存;B项,抑制了水的电离,溶液中存在大量的H+或OH-,但都不能与HCO3-共存;C项,溶液中的c(H+)=0.1mol/L,能与本组离子共存;D项,Fe3+能与SCN-发生络合反应。综上分析可知,本题选C项。
5. 设
设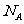 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.常温下,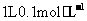 的
的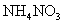 溶液中氮原子数为0.2
溶液中氮原子数为0.2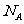
B.1mol羟基中电子数为10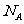
C.在反应中,每生成3mol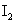 转移的电子数为6
转移的电子数为6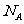
D.常温常压下,22.4L乙烯中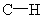 键数为4
键数为4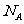
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com