
18.(12分)
(1)①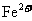 在碱性条件下更易被氧化(凡合理答案均可)
在碱性条件下更易被氧化(凡合理答案均可)
②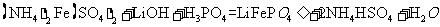
③与空气中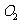 反应,防止
反应,防止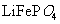 中的
中的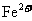 被氧化
被氧化
(凡合理答案均可)
(2)①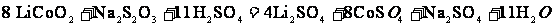 ②
② 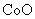
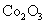 、
、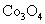
(1)2.0 mol·L
(2)NH4Cl
(3)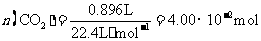
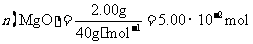

17.(8分)
(1)A、C
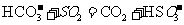
(2)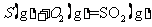
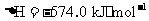
(3)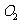 、
、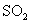
16.(10分)
(1)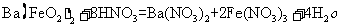
(2)防止反应速率过快 浓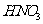 易挥发、分解
易挥发、分解
(凡合理答案均可)
(3)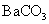
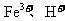
(4)减少废渣中可溶性钡盐对环境的污染
(凡合理答案均可)
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用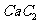 与水反应生成乙炔。
与水反应生成乙炔。
(1) 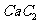 中
中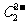 与
与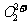 互为等电子体,
互为等电子体,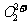 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol 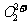 中含有的
中含有的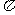 键数目为
。
键数目为
。
(2)将乙炔通入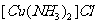 溶液生成
溶液生成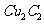 红棕色沉淀。
红棕色沉淀。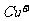 基态核外电子排布式为
。
基态核外电子排布式为
。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈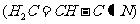 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
(4) 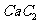 晶体的晶胞结构与
晶体的晶胞结构与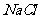 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但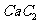 晶体中含有的中哑铃形
晶体中含有的中哑铃形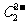 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。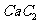 晶体中1个
晶体中1个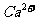 周围距离最近的
周围距离最近的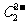 数目为
。
数目为
。
 B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
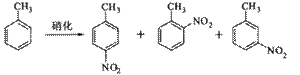
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在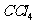 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
|
催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
|
n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
|
浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
|
1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
|
0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
|
0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。


(凡合理答案均可)
20. (10分)以水氯镁石(主要成分为
(10分)以水氯镁石(主要成分为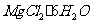 )为原料生产碱式碳酸镁的主要流程如下:
)为原料生产碱式碳酸镁的主要流程如下:
(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的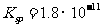 ,若溶液中
,若溶液中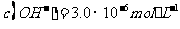 ,则溶液中
,则溶液中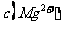 =
。
=
。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。
(3)高温煅烧碱式碳酸镁得到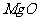 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下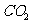 0.896L,通过计算确定碱式碳酸镁的化学式。
0.896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有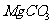 ,则产品中镁的质量分数 ▲ (填 “升高”、“降低”或“不变”)。
,则产品中镁的质量分数 ▲ (填 “升高”、“降低”或“不变”)。

(4)升高
[解析]本题主要考查的是有关Ksp的计算和无机化工流程和化学计算。(1)依据Ksp计算的公式可知c(Mg2+)=Ksp/c2(OH-)= 2.0mol/L;(2)通过流程分析,最后 综上分析可知,滤液中的主要成分为NH4Cl,浓缩以后得到的固体物质为NH4Cl;(3)根据题给相关物质的数据可有以下计算
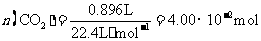
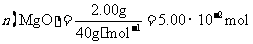
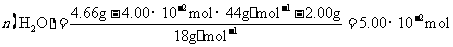
所以, ,从而得到其化学组成为;
,从而得到其化学组成为;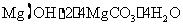 (4)因为MgCO3中Mg的含量比碱式碳酸镁的含量高,因此,混有MgCO3后,Mg的含量升高。
(4)因为MgCO3中Mg的含量比碱式碳酸镁的含量高,因此,混有MgCO3后,Mg的含量升高。
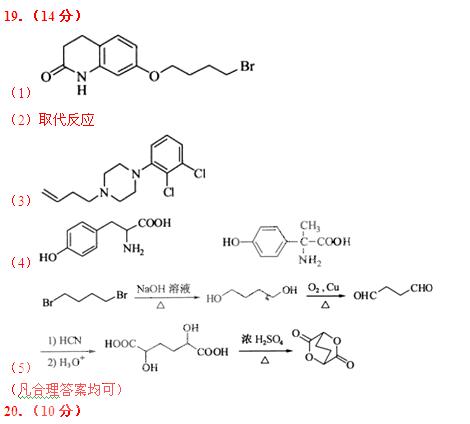
19. (14分)阿立哌唑(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。
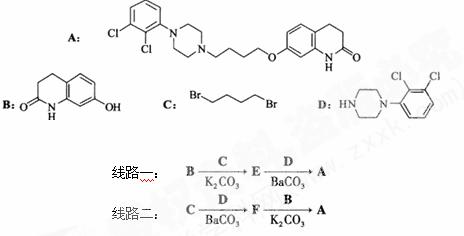
(1)E的结构简式为 。
(2)由C、D生成化合物F的反应类型是 。
(3)合成F时还可能生成一种相对分子质量为285的副产物G,G的结构简式为 。
(4)H属于 氨基酸,与B的水解产物互为同分异构体。H能与
氨基酸,与B的水解产物互为同分异构体。H能与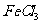 溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:
。
溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:
。
(5)已知: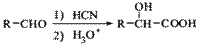 ,写出由C制备化合物
,写出由C制备化合物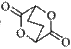 的合成路
的合成路
线流程图(无机试剂任选)。合成路线流程图示例如下:
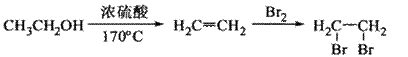
[答案](1)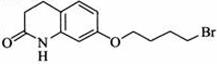
(2)取代反应
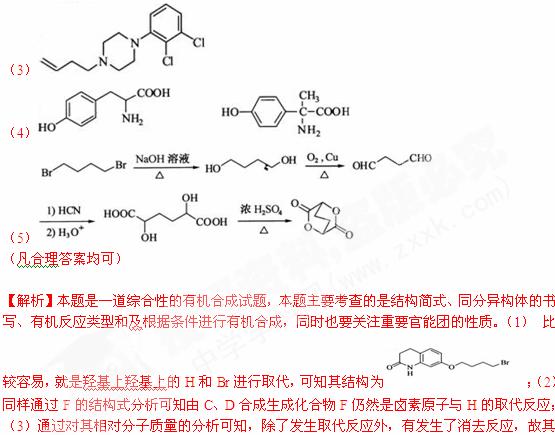 结构为
结构为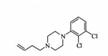 ;(4)综上分析可知,在H分子结构中,有苯环、氨基、羧基、羟基,由此不难得出其分子结构为
;(4)综上分析可知,在H分子结构中,有苯环、氨基、羧基、羟基,由此不难得出其分子结构为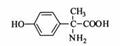 和
和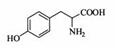 ;(5)关注官能团种类的改变,搞清反应机理。
;(5)关注官能团种类的改变,搞清反应机理。
[备考提示]解答有机推断题时,我们应首先认真审题,分析题意,分离出已知条件和推断内容,弄清被推断物和其他有机物的关系,以特征点作为解题突破口,结合信息和相关知识进行推理,排除干扰,作出正确推断,一般可采取的方法有:顺推法(以有机物结构、性质和实验现象为主线,采用正向思维,得出正确结论)、逆推法(以有机物结构、性质和实验现象为主线,采用逆向思维,得出正确结论)、多法结合推断(综合应用顺推法和逆推法)等。
18. (12分)正极材料为
(12分)正极材料为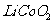 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型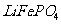 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过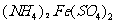 、
、 与
与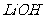 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将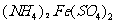 和
和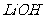 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向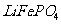 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的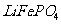 的导电性能外,还能
。
的导电性能外,还能
。
(2)废旧锂离子电池的正极材料试样(主要含有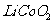 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
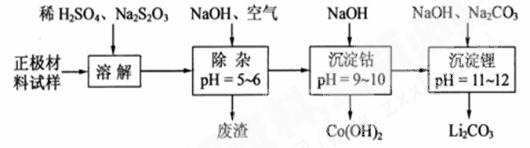
①
 在上述溶解过程中,
在上述溶解过程中,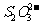 被氧化成
被氧化成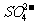 ,
,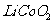 在溶解过程中反应的化学方程式为
。
在溶解过程中反应的化学方程式为
。
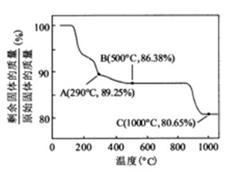
②
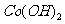 在空气中加热时,固体残留率随温度的变化
在空气中加热时,固体残留率随温度的变化
如右图所示。已知钴的氢氧化物加热至290℃时已完全
脱水,则1000℃时,剩余固体的成分为 。(填化学式);
在350~400℃范围内,剩余固体的成分为 。(填化学式)。

 ②
② 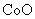
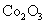 、
、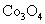

17.(8分)下表列出了3种燃煤烟气脱硫方法的原理。
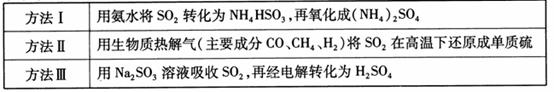
(1) 方法Ⅰ中氨水吸收燃煤烟气中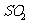 的化学反应为:
的化学反应为:
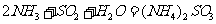
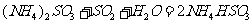
能提高燃煤烟气中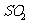 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使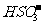 转化为
转化为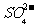
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的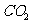 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
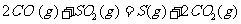
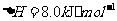
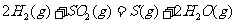
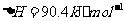
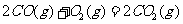
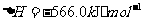

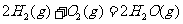
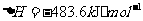
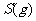 与
与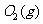 反应生成
反应生成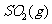 的热化学方程式为
。
的热化学方程式为
。
(3) 方法Ⅲ中用惰性电极电解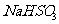 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为 。
(填化学式)
16.(10分)钡盐行业生产中排出大量的钡泥[主要含有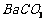 、
、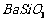 、
、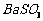 、
、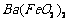 等]。某主要生产
等]。某主要生产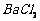 、
、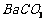 、
、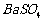 的化工厂利用钡泥制取
的化工厂利用钡泥制取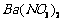 ,其部分工艺流程如下:
,其部分工艺流程如下:
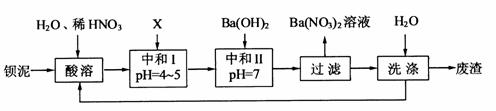
(1)酸溶后溶液中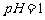 ,
,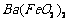 与
与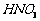 的反应化学方程式为
。
的反应化学方程式为
。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,
原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。

(凡合理答案均可)
[解析]本题主要考查的是无机化工流程的分析,此题为化工生产题型,主要考察了化合物性质。(1)Ba(FeO2)2与HNO3反应,生成对应的硝酸盐;(2)控制温度,不用浓硝酸的目的是控制反应速率,防止反应速率过快;同时浓硝酸容易挥发分解;(3)通过产物,结合溶液的酸碱性,选用的X为BaCO3,在I中有Fe3+、H+和Ba2+、NO3-等,加入BaCO3后,能使Fe3+和H+浓度降低;(4)在废渣中有可溶性钡盐,有毒,因此,洗涤的目的是减少可溶性钡盐对环境的污染。
15.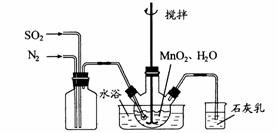 (12分)高纯
(12分)高纯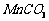 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以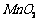 为原料制备少量高纯
为原料制备少量高纯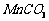 的操作步骤如下:
的操作步骤如下:
(1)制备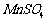 溶液:
溶液:
在烧瓶中(装置见右图)加入一定量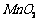 和水,搅拌,
和水,搅拌,
 通入
通入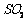 和
和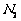 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入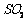 ,
,
继续反应片刻,过滤(已知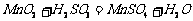 )。
)。
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使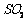 尽可能转化完全,在通入
尽可能转化完全,在通入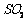 和
和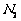 比例一定、不改变固液投料的条件下,可采取的合理措施有
、
。
比例一定、不改变固液投料的条件下,可采取的合理措施有
、
。
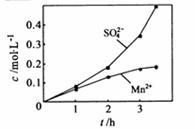
③若实验中将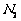 换成空气,测得反应液中
换成空气,测得反应液中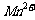 、
、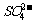 的浓度随反应时间t变化如右图。导致溶液中
的浓度随反应时间t变化如右图。导致溶液中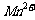 、
、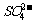 浓度变化产生明显差异的原因是
。
浓度变化产生明显差异的原因是
。
(2)制备高纯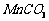 固体:已知
固体:已知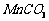 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;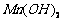 开始沉淀时
开始沉淀时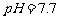 。请补充由(1)制得的
。请补充由(1)制得的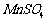 溶液制备高纯
溶液制备高纯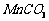 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: 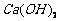 、
、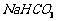 、
、 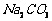 、
、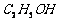 ]。
]。
① ;② ;③ ;④ ;⑤低于100℃干燥。

(凡合理答案均可)
[解析]本题主要考查的是实验的基本操作、实验仪器的选择、实验误差分析。因此实验基础的考察依然是以后学习和复习的重点。(1)①石灰乳参与反应主要是与SO2的反应。②为是SO2尽快转化,在比例不变的情况下,可以通过控制温度或控制气体的流速以确保反应的充分进行;③从图中可以看出,c(Mn2+)减少,c(SO42-)增加,可以认为Mn2+在O2与H2SO3反应中起了催化作用;(2)根据题给信息,可以得出制备高纯MnCO3的操作流程:加入NaHCO3溶解,同时控制溶液的pH<7.7→过滤、洗涤→检验SO42-是否被除去→为了降低MnCO3的损耗,用C2H5OH洗涤→低温干燥。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com