
17. (8分)醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。
(8分)醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。

已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
(1)乙醇脱水制乙烯的反应是 ▲ (填“放热”、“吸热”)反应,若增大压强,平衡 ▲ (选填“正向”、“逆向”、“不”)移动。
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式 ▲ 。当乙醇起始浓度相同时,平衡常数K值越大,表明 ▲ (填序号)。
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(3)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量 ▲ (选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是 ▲ 。
16.(10分)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定室内空气中甲醛含量不得超过0.08 mg/m3。
(1)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量
(资料:4NH4++6HCHO=(CH2)6N4H++3H++6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂)。
用甲醛法测定含氮量,不适合的铵盐是 ▲ (填字母)。
a.NH4HCO3 b.(NH4)2SO4 c.NH4Cl
(2)工业制甲醛的两种方法如下(数据均为298.15 K下测定):
反应I:CH3OH(g)→HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11
反应II:CH3OH(g)+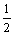 O2(g)→HCHO(g)+H2O(g) ΔH2=-149.73kJ/mol,K2=4.35×1029
O2(g)→HCHO(g)+H2O(g) ΔH2=-149.73kJ/mol,K2=4.35×1029
 ①绿色化学提倡化工生产应提高原子利用率。反应 ▲ (填“I”或“II”)制甲醛原子利用率更高。从反应的焓变和平衡常数K值看,反应 ▲ (填“I”或“II”)制甲醛更加有利。
①绿色化学提倡化工生产应提高原子利用率。反应 ▲ (填“I”或“II”)制甲醛原子利用率更高。从反应的焓变和平衡常数K值看,反应 ▲ (填“I”或“II”)制甲醛更加有利。
② 反应Ⅱ自发进行的条件是 ▲ (填字母)。
a.高温 b.低温 c.任何条件
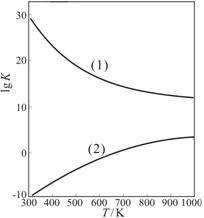
③ 右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 ▲ (填“I”或“II”)。
(3)某研究性学习小组测定居室中甲醛的含量的原理如下:
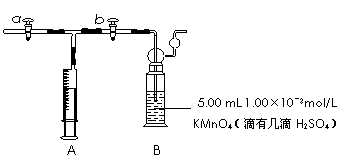 4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
打开a,关闭b,用注射器抽取室内空气;关闭b,打开a,再推动注射器,将气体全部推入酸性KMnO4溶液中,使其充分反应。当B装置中 ▲ 时停止推气。若总共取样为500 L空气,则该居室内空气中甲醛的浓度 ▲ mg/m3。
15.(12分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 ▲ 极相连,阴极上的电极反应式为 ▲ 。
电解过程中,硫酸铜的浓度会 ▲ (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,该步反应的离子方程式为 ▲ 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
|
序号 |
反应 |
化学平衡常数 |
|
1 |
Au + 6HNO3(浓)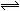 Au(NO3)3 +
3NO2↑+ 3H2O Au(NO3)3 +
3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 ▲ 。
 (2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+ 的浓度为 ▲ mol·L-1 ,Fe2+的浓度为 ▲ mol·L-1。
14.(9分)某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65%, SiO2含量约20%,Al2O3含量约4%,其余为水分;闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
|
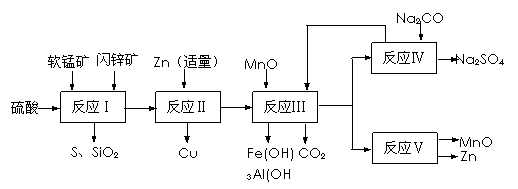

请回答下列问题:
(1)反应Ⅰ后过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试写出反应Ⅰ中生成CuSO4的化学方程式 ▲ 。
(2)反应Ⅱ加入适量锌的作用是 ▲ 。如果锌过量,还会进一步发生反应的离子方程式为 ▲ 。
(3)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为 ▲ 。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要的原料是 ▲ 。
13.(10分)照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。
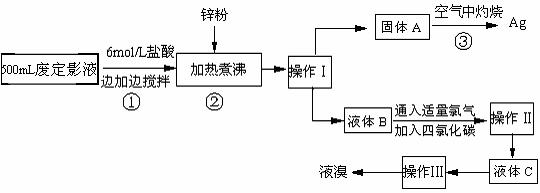 (已知:4H++2 [Ag(S2O3)2]3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
(已知:4H++2 [Ag(S2O3)2]3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
⑴操作Ⅲ的名称是 ▲ ;操作Ⅱ需要的主要玻璃仪器有 ▲ 。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 ▲ 。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 ▲ 。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 ▲ 。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 ▲ 。
12.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1 = 4.3×l0_7 K2 = 5.6×l0_11 |
现维持25℃,下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),
则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3溶液中:c(OH-)-c(H+) = c(H2CO3)-c(CO32-)
第Ⅱ卷(非选择题 共78分)
11.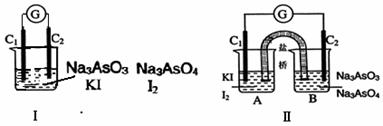 下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ 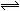 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I-
10.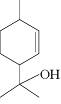
 松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调合香精。松油醇结构如右图所示,下列有关松油醇的叙述错误的是
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调合香精。松油醇结构如右图所示,下列有关松油醇的叙述错误的是
A.松油醇的分子式为C10H18O
B.松油醇能发生加成反应、消去反应、氧化反应、酯化反应
C.松油醇存在酚类的同分异构体,分子中有2个手性碳原子
D.松油醇分子在核磁共振氢谱中有7个吸收峰
9.阿伏加德罗常数为NA mol-1,下列说法中正确的是
A.标准状况下2.24L甲苯含有的碳原子数目为0.7 NA
B.足量Zn与一定量的浓硫酸反应,产生标准状况下22.4L气体时,转移的电子数一定为2NA
C.通常状况下14 g N2和CO的混合气体含有的原子数目为 NA
D.71g氯气通入足量水中,反应中转移的电子总数为NA
8.下列离子方程式正确的是
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液:
Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
B.向NH4Al(SO4)2溶液中滴入B a(OH)2使SO42-恰好完全反应:
2Ba2++4OH-+Al3++2SO42-=BaSO4↓+AlO2-+2H2O
C.足量的CO2通入饱和碳酸钠溶液中:
CO2+CO32-+H2O=2HCO3-
D.向Fe(NO3)2溶液中加入稀盐酸:
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com