
4.一定量某有机物溶解于适量的NaOH溶液中,滴入酚酞,溶液呈红色,煮沸5min后,溶液颜色变浅,再加入盐酸显酸性,沉淀出白色晶体。取少量晶体放到FeCl3溶液中,溶液呈紫色,则该有机物可能是 ( )
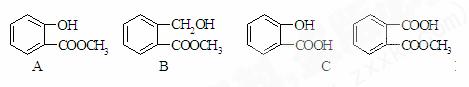
解析:加NaOH煮沸后碱性减弱,从所给物质可知应发生水解,最后产物加氯化铁溶液呈紫色,则含有酚羟基,故选A。
答案:A
3.已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是 ( )
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓 盐酸
盐酸
D.甲是浓硝酸,乙是浓氨水
解析:产生白色烟环应是浓氨水和挥发性酸反应的现象,故可排除选项A,由图知白色烟环离甲远,说明甲分子的摩尔质量小于乙分子的摩尔质量,扩散速率快,可知选项C符合。
答案:C
2.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是 ( )

解析:A中要干燥氯气,进气管应插入浓硫酸中;在石油分馏实验中,温度计应放在蒸馏烧瓶的支管口处;D中用稀硫酸可以吸收氨气,但会出现倒吸,所加的苯密度小浮在上层,达不到防止倒吸的目的,可改用四氯化碳。
答案:B
1.下列有关苯酚性质,制法的说法,错误的是( ) A.与苯相似,也能发生硝化反应。
B.在它的溶液中加入FeCl3溶液后显紫色。
C.与乙醇相同,羟基中的氢原子可被金属取代,苯酚不能被氢氧化钠中和。
D.往苯酚钠溶液中通CO2,可生成苯酚和碳酸氢钠。
解析:苯酚中的羟基直接连接在苯环上,苯环对羟基的影响,使其变的更活泼,能发生电离,表现出弱酸性,故能与NaOH发生中和反应。
答案:C
2.乙醇和苯酚的性质探究:
|
实验探究项目 |
实验方案设计 |
|
乙醇和苯酚分别与金属钠反应产生氢气的速率大小比较 |
室温下,乙醇呈液态,苯酚呈固态;为了比较二者与金属钠反应的反应速率,应控制反应在相同状况下进行,如均在液态下进行,采取的措施是在乙醚中进行反应 |
|
乙醇的氧化反应 |
乙醇和强氧化剂酸性重铬酸钾溶液反应的现象: 溶液由橙黄色变成蓝色溶液 溶液由橙黄色变成蓝色溶液 |
|
乙醇的脱水反应 |
要是乙醇发生分子内脱水,所用的脱水剂为浓硫酸; 证明脱水反应发生的实验现象是:生成的气体通入溴水或酸性高锰酸钾溶液,溶液褪色 |
|
苯酚的化学性质 |
苯酚水溶液中加入氯化铁溶液的现象:紫色 苯酚水溶液中加入浓溴水可观察到的现象:出现白色沉淀 |
|
比较盐酸、碳酸、苯酚的酸性强弱 |
证明盐酸酸性强于碳酸的有关反应的化学方程式: Na2CO3+2HCl=2NaCl+H2O+CO2↑ 证明碳酸酸性强于苯酚的有关反应的化学方程式: C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 |
[特别注意]苯酚钠与CO2反应是只能生成NaHCO3。酸性强弱顺序为H2CO3 > C6H5OH > NaHCO3 ,对应离子获取H+的能力大小为:HCO3- < C6H5O- < CO32-。
[考点再现]
考点一 物质性质探究
例1 (1)将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是二元弱酸(H2O2
 H++H
H++H O2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
设计方案
O2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
设计方案 为: 。
为: 。
(2)甲同学向品红溶液中通入一种气体后,品红褪色。乙同学设计了一个很简便的实验便知甲同学通的是Cl2还是SO2。他的实验方案是 。
 考点二 考查物质的性质
考点二 考查物质的性质
例2 下面有关苯酚的叙述正确的是 ( )
①是有机化工原料,可以制电木;②易溶于水也易溶于乙醇;③可以使紫色石蕊溶液变红; ④酸性比甲酸、乙酸、碳酸均弱;⑤可以和硝酸发生酯化反应; ⑥常温下易被空气氧化;⑦既可以和H2发生加成反应,又可以和溴水发生取代反应。
A.①③⑥⑦ B. ①②③④⑦ C. ①④⑥⑦ D.②③⑤⑥⑦
解析:苯酚可以与甲醛反应制取电木;苯酚常温下在水中溶解度较小;虽然苯酚具有酸性,但酸性很弱,不能使石蕊溶液变红,比甲酸、乙酸、碳酸等都要弱。在空气中容易被氧化而呈粉红色,还可以与氢气发生加成反应,可与浓溴水发生取代反应。
答案:C
考点三 物质的性质探究实验的设计
例3 为验证淀粉能水解,且水解的生成物有还原性能,可能用到如下某些实验步骤,则正确的实验程序是( )①加入稀硫酸;②加入几滴硫酸铜溶液;③加热;④加入蒸馏水;⑤加入烧碱溶液至显碱性; ⑥加入新制Cu(OH)2
A. ④①③⑥③ B.④③①⑥⑤③ C. ①③②⑥③ D.④①③⑤⑥③
解析:需要对淀粉性质探究,先要验证其能水解,再验证水解产物具有还原性,可以用新制Cu(OH)2,注意要先中和溶液中的稀 硫酸,使溶液呈碱性才能验证生产物的还原性。故实验程序为D。
硫酸,使溶液呈碱性才能验证生产物的还原性。故实验程序为D。
答案:D
[专题训练]
|
|
乙醇 |
苯酚 |
|
官能团 |
羟基-OH |
羟基-OH |
|
结构特点 |
羟基与链烃基相连,不电离 |
羟基与苯环直接相连,可电离 |
|
主要化 学性质 |
①与钠反应放出氢气; ②与HX发生取代反应; ③消去反应; ④分子间脱水  反应; 反应;⑤燃烧和催化氧化; ⑥酯化反应 |
①弱酸性,能与NaOH、Na反应; ②与浓溴水发生取代反应生成白色沉淀; ③遇FeCl3发生显色反应 |
|
特征反应 |
红热的铜丝插入醇中,有刺激性气味的乙醛生成 |
与浓溴水反应生成白色沉淀 遇氯化铁显紫色 |
[要点探究]
1.铝及其化合物性质的探究:
|
实验内容 |
操作 |
实验现象 |
结论与化学方程式 |
|
铝与氧气反应 |
将铝条绕成螺旋状,一段绕紧一根火柴,实验时点燃火柴,待火柴快要烧完时伸入盛有氧气的集气瓶中。 |
铝条燃烧并发出火光 |
4Al+3O2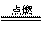 2Al2O3 2Al2O3 |
|
铝表面氧化膜的实验探究 |
 擦去氧化膜的铝片伸入0.5mol·L-1 CuSO4溶液 擦去氧化膜的铝片伸入0.5mol·L-1 CuSO4溶液 |
铝表面有紫红色物质析出[ |
2Al+3CuSO4=Al2(SO4)3+3Cu |
未擦去氧化膜的铝片伸入0.5mol·L-1
CuSO4溶 液 液 |
无明显现象 |
|
|
|
未擦去氧化膜的铝片,先放入6.0mol·L-1 NaOH溶液中,观察。取出,洗净,放入0.5mol·L-1
CuSO4溶液中 |
铝表面有紫红色物质析出 |
Al2O3+2NaOH=2NaAlO2+H2O 2Al+3CuSO4=Al2(SO4)3+3Cu |
|
擦去氧化膜的铝片 放入盛有浓硝酸的试管中,观察。取出,洗净后放入0.5mol·L-1 CuSO4溶液中,观察现象。 放入盛有浓硝酸的试管中,观察。取出,洗净后放入0.5mol·L-1 CuSO4溶液中,观察现象。 |
无明显现象 |
|
|
|
铝络合物的生成 |
试管中加入1mL 1.0mol·L-1 AlCl3溶液,再加入2mL 10% NH4F溶液,再滴加1mL 3.0mol·L-1 NH3·H2O溶液,观察现象。 |
产生白色沉淀 |
Al3++6F-=AlF63- 生成配合物(NH4)3AlF6 |
3.可溶性铝盐的性质
可溶性铝盐电离出Al3+水解产生胶体具有吸附性,常用于作净水剂等。
铝能形成多种配合物,如Al(OH)4-、AlF63-等。配合物是由提供孤电子对的配位体(阴离子或分子)与接受孤电子对的中心原子(或离子)以配位键结合形成的一种化合物。
Al3++6F-===AlF63- Al3++4OH-===Al(OH)4-
2.氧化铝和氢氧化铝的两性
氧化铝和氢氧化铝都是两性化合物,能与强酸溶液反应,又能与强碱溶液反应。
Al203+6H+===2Al3++3H2O 3H2O+Al2O3+2OH-===2Al(OH)4-
Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===2Al(OH)4-
1.铝的化学性质
铝是活泼性较强的金属,在一定条件下能与非金属单质、酸、碱。某些可溶性的盐反应。铝在空气中或在冷的浓硝酸中都能生成一层结构致密的氧化膜薄膜,对金属起到保护作用。但当有氯离子存在时,铝表面的氧化膜易被破坏,因此铝制容器不能用来腌制咸菜。
3.研究 物质性质的基本方法和基本程序是密不可分的,二者相互结合对物质性质进行探究,通过观察法初步了解外观性质,再运用分类法,根据物质所属类别等预测物质的相关性质,利用实验法进
物质性质的基本方法和基本程序是密不可分的,二者相互结合对物质性质进行探究,通过观察法初步了解外观性质,再运用分类法,根据物质所属类别等预测物质的相关性质,利用实验法进 行性质验证,根据实验现象运用比较法,进一步归纳物质的性质。
行性质验证,根据实验现象运用比较法,进一步归纳物质的性质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com