
5.从存放号码分别为1,2,…,10的卡片的盒子中,有放回地取100次,每次取一张卡片并记下号码,统计结果如下:
|
卡片号码 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
取到的次数 |
13 |
8 |
5 |
7 |
6 |
13 |
18 |
10 |
11 |
9 |
取到号码为奇数的频率是 ( )
A. 0.53 B. 0.5 C. 0.47 D. 0.37
 A.
A. 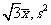 B.
B.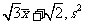 C.
C. D.
D. 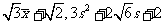
4.若角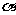 的终边上有一点
的终边上有一点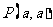 ,
,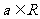 且
且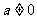 ,则
,则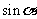 的值是
( )
的值是
( )
A. 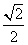 B.
B. 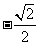 C.
C. 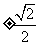 D. 1
D. 1
3.设有一个回归直线方程为 ,则变量
,则变量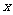 增加一个单位时( )
增加一个单位时( )
A. 平均增加
平均增加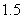 个单位
B.
个单位
B. 平均增加
平均增加 个单位
个单位
C. 平均减少
平均减少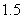 个单位
D.
个单位
D. 平均减少
平均减少 个单位
个单位
2.有20位同学,编号从1至20,现在从中抽取4人作问卷调查,用系统抽样方法确定所抽的编号为( )
A.5,10,15,20 B.2,6,10,14 C.2,4,6,8 D.5,8,11,14
1.下面一段程序执行后输出结果是 ( )
程序: A=2
A=A*2
A=A+6
PRINT A
A. 2 B. 8 C. 10 D. 18
28.(14分)
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有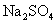 、
、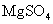 、
、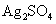 、
、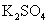 等4中溶液,可与实验中
等4中溶液,可与实验中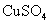 溶液起相似作用的是
;
溶液起相似作用的是
;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有 (答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
|
实验 混合溶液 |
A |
B |
C |
D |
E |
F |
|
4mol/L H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
选考:37.[化学-选修物质结构与性质](15分)
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高。请回答下列问题:
(1)W原子L层电子排布式为 W3空间构形是
(2)X单质与水反应的主要化学方程式
(3)化合物M的化学式 其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有
,O-C-O的键角约
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=
(5)含有元素Z的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是
选考:38.[化学--选修有机化学基础](15分)
PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线:
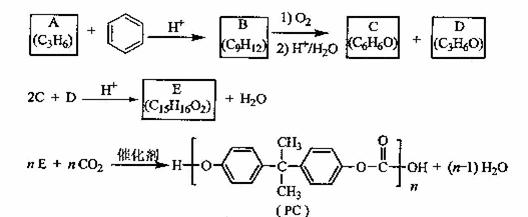
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)A的化学名称是 ;
(2)B的结构简式为--;
(3)C与D反应生成E的化学方程式为 ;
(4)D有多种同分异构体,其中能发生银镜反应的是 (写出结构简式);
(5)B的同分异构体中含有苯环的还有 种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是 (写出结构简式)。
27.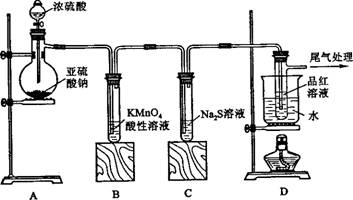 (15分)
(15分)
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是
,其中发生反 应的化学方程式为
;
应的化学方程式为
;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
溶液吸收。
26.(14分)
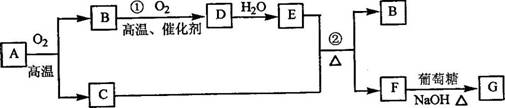
物质A-G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。
请回答下列问题:
(1)写出下列物质的化学式:B 、E 、G ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ;
(3)反应②的化学方程式是 。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。
13.下表中评价合理的是( )
|
选项 |
化学反应及其离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2+8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸: CO32-+2H+==CO2+
H2O |
错误,碳酸镁不应该写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-==BaSO4¯ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2==2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1:2 |
必考:二、非选择题(共43分)
12.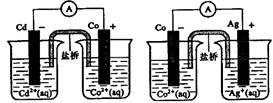 根据右图,可判断出下列离子方程式中错误的是( )
根据右图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)==2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq)
D. 2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com