
5. 同种元素的原子和离子一定具有相同的( )
A. 电子数 B. 质子数 C. 电子层数 D. 最外层电子数
4. 下列物质中属于氧化物的是( )
A. KMnO4 B. NO2 C. C6H12O6 D. FeCl3
3. 下列元素属于非金属元素的是( )
A. 氧 B. 铜 C. 氦 D. 汞
2. 空气的成分中,体积分数约占78%的是( )
A. 氧气 B. 氮气 C. 二氧化碳 D. 稀有气体
1. 下列现象中属于化学变化的是( )
A. 汽油挥发 B. 燃放烟花 C. 衣服晾干 D. 轮胎爆炸
(四)有关金属的综合推断题
[例1] 某小组收集到一些生锈的废铁屑样品,按下图所示进行实验。已知:甲、丙含有相同的-2价原子团,乙为气态化合物,A、C为气体。
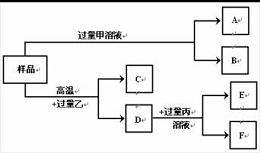
(1)下列与废铁屑生锈有关的物质是 。
A. 水 B. 氧气 C. 氮气 D. 二氧化碳
(2)样品与乙的高温反应是炼铁的主反应,写出其反应的化学方程式
(3)若丙溶液为蓝色,则D与丙反应的化学方程式为 。
(4)已知+3价铁盐溶液可与铁单质反应生成+2亚铁盐溶液。请你推测样品与过量甲溶液可能发生 个反应,其中既不属于置换反应又不属于化合反应的化学方程式为 。
答案:(1)AB (2)3CO+ Fe2O3 高温 2Fe + 3CO2
(3)Fe+CuSO4=Cu+FeSO4
(4)3;Fe2O3 +3H2SO4=Fe2(SO4)3 +3H2O
[例2] 已知A~G七种物质都是初中化学课本中出现过的化合物,其中F是常用的建筑材料;H为常见的单质。各物质之间存在如下转化关系(反应条件如下图所示)。
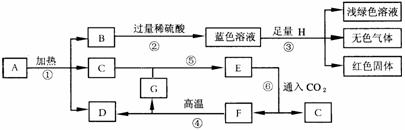
(1)请写出物质A的化学式 。
上述蓝色溶液中的溶质有 、 。
(2)在①~⑥反应中属于化合反应的是 (填序号)。
(3)上述转化过程中,有能够反映我国古代人民在化学方面对人类作出伟大贡献的变化。请举出其中一例,用化学方程式表示 。
答案:(1)Cu2(OH)2CO3 CuSO4 H2SO4
(2)⑤ (3)Fe+CuSO4=Cu+FeSO4(或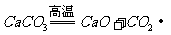 )
)
[模拟试题]
可能用到的相对原子质量:C-12 H-1 O-16 Ca-40 Na-23 Cl-35.5 S-32 Mg-24 Zn-65
部分碱和盐的溶解性表(20℃)
|
阳离子 阴离子 |
Ba2+ |
Ca2+ |
Mg2+ |
Zn2+ |
Fe2+ |
Na+ |
Cu2+ |
|
OH– |
溶 |
微 |
不 |
不 |
不 |
溶 |
不 |
|
SO42- |
不 |
微 |
溶 |
溶 |
溶 |
溶 |
溶 |
|
CO32- |
不 |
不 |
微 |
不 |
不 |
溶 |
不 |
|
NO3- |
溶 |
溶 |
溶 |
溶 |
溶 |
溶 |
溶 |
|
Cl- |
溶 |
溶 |
溶 |
溶 |
溶 |
溶 |
溶 |
第I卷 (选择题 共30分)
(三)有关给图像的计算题
注意:分析好图中给出的关键点,找出恰好完全反应的点,代入方程式计算。
1. 向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300g。
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?
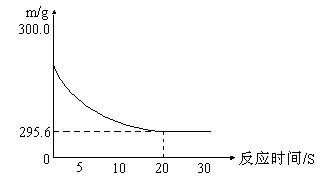
答案:(1)20 (2)4.4 (3) 10%
2. 在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0 g后,再加入68.9 g稀盐酸恰好完全反应。反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如右图所示。烧杯连同药品的起始总质量为165.0 g。反应的方程式为:
NaHCO3+HCl==NaCl+H2O+CO2↑
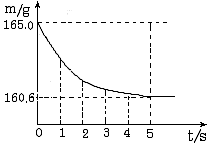
试回答下列问题:
(1)完全反应时产生二氧化碳的质量为_____g
(2)原混合物中氯化钠的质量。
(3)反应后所得氯化钠溶液中溶质质量分数。
答案:(1)4.4 (2)1.6g (3)10%
(二)根据给定信息完成化学方程式
注意:反应物和生成物的化学式书写;方程式的配平;反应条件、气体、沉淀符号的标明。
(1)为适应火车提速,沪宁线上原有的短轨已全部连接为超长轨。工程技术人员常用点燃铝热剂(铝粉和氧化铁粉末的混合物,能释放大量的热量)的方法来生成熔融状态的铁,从而焊接钢轨间的缝隙。写出有关的化学方程式________________,其中还原剂是_____,其基本反应类型是__________。
(2)钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质。当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式___________。
(3)NO是大气污染物之一,目前有一种治理方法是在400℃左右、有催化剂存在的条件下,用氨气把NO还原为氮气和水:__________。
(4)过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
(5)科学家预言:“未来最理想的燃料是绿色植物。”绿色植物的秸秆[主要成分是纤维素,化学式为(C6H10O5)n]。在有适当催化剂的条件下,与水作用生成葡萄糖(化学式为C6H12O6),葡萄糖在有适当催化剂的条件下,可转化成乙醇和二氧化碳。乙醇是较理想的燃料。写出两步转化的化学方程式_________________,____________________
(一)运用质量守恒定律的问题
质量守恒定律的内容--参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总合。
[例1] 将A、B、C三种物质各10克,加热进行化合反应生在成D ,其中B是催化剂,当A完全反应后,生成D 16克,则反应后混合物中B与C的质量比是( )
A. 5∶1 B. 5∶2 C. 5∶3 D. 4∶1
答案:B
[例2] 某有机物燃烧是发生的反应为:2X+15O2===12CO2+6H2O,则X的化学式( )
A. C2H4 B. C2H6 C. CH4 D. C6H6
答案:D
[例3] 有一有机物23克,在空气中燃烧后,若生成二氧化碳44克和27克水,则该有机物含碳元素的质量是( )克,含氧元素的质量是( )克, 该有机物是由( )组成。
答案:12克,6克,碳、氢、氧
[例4] 现有A、B、C3种物质各15克,充分反应后生成 D物质30克,此时C 已完全反应,若再加入10克C,A恰好完全反应,则参加反应A与B的质量比( )
A. 3∶2 B. 2∶3 C. 1∶1 D. 3∶5
答案:A
[例5] 已知反应A+B→C,若将7gA和2gB或4gA和7gB混合,在一定条件下充分反应后,均可得到6gC,若A和B混合物9g,充分反应后得到7.5gC,则此混合物中A的质量可能是 g或 g。
答案:5或6.5
归纳掌握教材中的典型性问题,掌握典型题目的解法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com