
26.(8分)请根据离子反应 Fe + Cu2+ === Fe2+ + Cu
设计一个带盐桥的原电池,并完成下列问题。
(1)请在右边的方框中画出带盐桥的原电池构造示意图。
(2)指出该原电池的正负极电极材料、电极反应式。
正极电极材料: 负极电极材料:
正极电极反应:
负极电极反应:
云龙中学2009学年第二学期6月考(高二化学)答题卷
一选择题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
25. (18分)可逆反应A(g)+2B(g)  2C(g)
(正反应为放热),在一定条件下达到平衡,若改变条件,将变化情况(增大、减小、不变)填入空格:
2C(g)
(正反应为放热),在一定条件下达到平衡,若改变条件,将变化情况(增大、减小、不变)填入空格:
(1)升高温度,B转化率________,V正________,V逆________。
(2)使用催化剂,A的物质的量________,V正________,V逆________。
(3)保持温度和压强不变加入稀有气体,则C的物质的量________,A的转化率______。
(4)保持温度和体积不变加人稀有气体,则A的转化率________。
24. (4分)向50mL0.018 mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,生成沉淀。如果溶液中c(Ag+)、c(Cl-)的乘积是个常数:c(Ag+)·c(Cl-)=1.0×10-10,试求:(1)沉淀生成后溶液中c(Ag+)为________。(2)沉淀生成后溶液的pH是________。
23. (8分)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;氯化铝水溶液呈 性 ,原因是(用离子方程式表示):___________________ 。
22.(4分)物质的量浓度相同的①氨水;②氯化铵;③碳酸氢铵;④硫酸氢铵;⑤硫酸铵。5种溶液中c(NH4+)大小的顺序是 ______,溶液的pH大小的顺序是_______________________。
21.(6分) 由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出反应的热化学方程式:
。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+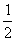 O2(g)
O2(g) H2O(1)的△H=
kJ·mol-1。氢气的燃烧热为
kJ·mol-1。[
H2O(1)的△H=
kJ·mol-1。氢气的燃烧热为
kJ·mol-1。[
2. 晚起不仅影响学习,而且也是一种坏习惯; 3. 早起是一种好习惯,因为它能给你带来很多好处。早起有助于身体健康,有助于学习,有助于品德培养。英国有句俗话,“Early to bed, and early to rise makes a man healthy, wealthy and wise.”这是千真万确的,希望大家养成早起的习惯。
(注:品德培养 train character;俗话 a saying)
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1. 有些学生迟到,是因为晚起;
75. What a beautiful lake. The scenery is perfect beyond (形容).
第四节 书面表达 (满分30分)
以“Form a Good Habit”为题,谈谈早起的好处。要求言之有理,内容连贯,词数100-120。可参考以下提示:
74. As is known to all of us, gold is _____ (相似) in colour to brass.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com