
31.[化学--有机化学基础](13分)
A、B、C、D四种芳香族化合物有的是药物、有的是香料。它们的结构简式如下所示:
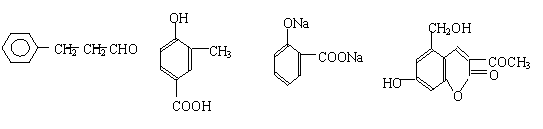

A B C D
请回答下列问题:
(1)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有 (用A、B、C、D填空)。
(2)1molA最多能与 molH2发生加成反应。
(3)B分子中含有的官能团是______________(填写名称);B的同分异构体中,苯环上有两个邻位取代基,分别为“-OH”和含有“-COO-”结构的基团共有4种,其中两种(G和H)结构简式如下图所示,请补充另外两种。
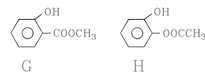 、 。
、 。
(4)2006年齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。D是“亮菌甲素”的结构简式,它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。 “亮菌甲素” 不能发生的反应类型是 。 A.取代反应 B.消去反应 C.加成反应 D.氧化反应
(5)已知:①-COOH连接在苯环上,酸性显著增强。②醇和酸在催化剂作用下可直接反应生成酯,而酚不能。酚只能跟有机酸酐作用生成酯。例如:

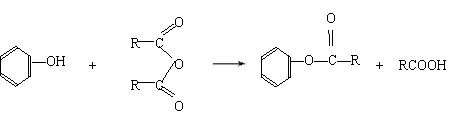

现以C为基本原料,请选择必要的其他反应物,用最佳途径合成
请写出其反应的化学方程式:
① ;
② 。
30.[化学--物质结构与性质](13分)
(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 ;
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为 。
(3)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间的共价键含有 (填字母): a.2个σ键;b.2个π键;c.1个σ键、1个π键。
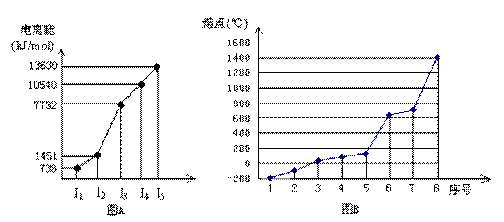
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第
族。
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。
(5)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: 。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是 。
29.[物理--选修3-5](共2小题, 每题6分,共12分。每小题只有一个选项符合题意)
(1)质子和中子的质量分别为m1和m2,当这两种核子结合成氘核时,并以γ射线的形式放出能量E。已知普朗克常量为h,真空中的光速为c,则氘核的质量和γ射线的频率的表达式分别为 (填选项前的字母)
A. -(m1+m2); B.(m1+m2)- ;
C.(m1+m2)- ; D. +(m1+m2);
(2)某同学利用如图所示的装置做《验证动量守恒定律的 实验》,已知两球的质量分别为m1、m2(且m1>m2),关于实验下列说法正确的有 (填选项前的字母)
A.如果M是m2的落点,则该同学实验过程中必有
 错误
错误
B.斜槽轨道必须很光滑
C.实验需要验证的是m1·OP=m2·O'M+m1·ON
D.实验需要秒表、天平、圆规等器材
28.[物理--选修3-3]略
27.(17分)为丰富植物育种的种质资源材料,经常利用钴60的γ射线辐射植物种子,筛选出不同性状的突变植株。请回答下列问题:
(1)钴60的γ辐射用于育种的方法属于 育种。
(2)从突变材料中选出抗盐新品种,利用该植株进行部分杂交试验:
① P:♀不抗盐 Χ ♂抗盐 → F1:不抗盐;
② P:♀抗盐 Χ ♂不抗盐 → F1:不抗盐。
由实验结果可知,抗盐性状的基因型是 (假设控制该性状的基因是A与a)
(3)从突变植株中还获得了显性高蛋白植株(纯合子),为验证该性状是否由一对基因控制,
请参与实验设计并完善实验方案:
① 步骤1:选择 和 杂交。
预期结果: 。
② 步骤2: 。
预期结果: 。
③ 观察实验结果,进行统计分析:如果 与 相符,可证明该性状由一对基因控制。
选考部分
本卷共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第29、30题都作答,则按第29题计分,若第31、32题都作答,则按第31题计分;第32题为生物题,是必答题。请将答案都填写在答题卷选答区域的指定位置上。
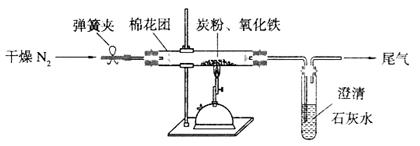
25.(15分)Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
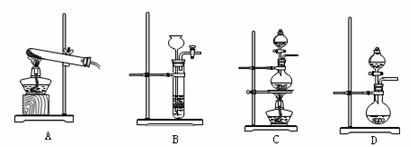
②下列装置可用于实验室制取氮气的是 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g ,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为
。
该实验中发生的化学方程式为
。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g) 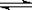 CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g)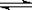 CH3CH2OH
(g)+H2O (g)
CH3CH2OH
(g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
CO转化率(%) |
|
1 |
150 |
1/3 |
0.1 |
|
|
2 |
x |
1/3 |
5 |
|
(1)实验1、2的目的是探究 对合成甲醇的影响,则x = 。
(2)若要探究温度、压强、碳氢比n(CO)/n(H2)、催化剂质量对合成甲醇的影响,除实验1、2外,至少还需进行 次对比实验。
(3)上述合成甲醇、乙醇的两个反应更符合绿色化学理念的是反应 (填编号),另一反应的平衡常数表达式为 。
26I.(13分)下图是真核细胞内部分能量转换关系图解,请据图回答问题:
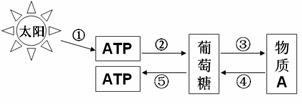
(1)①过程将光能转换为 ,发生的场所是叶绿体的 。
(2)若⑤过程发生在缺氧状态下,则发生的场所是 。
(3)通常在动植物细胞中都能发生的过程是 (填图中序号)。
(4)若物质A代表淀粉,则其来源于植物的光合作用。请写出简单实验思路加以证明。
26II.(10分)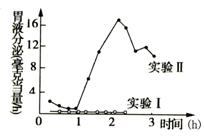 右图是对一位患有胃瘘的妇女所进行的临床实验结果。
右图是对一位患有胃瘘的妇女所进行的临床实验结果。
实验Ⅰ让该妇女吃麦片粥,该妇女明显对麦片粥厌恶;
实验Ⅱ让该妇女吃自选喜欢的食物如新鲜蔬菜、炸鸡腿、蛋糕等。两次实验中食物经咀嚼后都没有进入胃内。
(1)实验Ⅱ胃液分泌量高于实验Ⅰ,说明 会影响
低级神经中枢对胃液分泌的调节作用。
(2)把食物通过胃瘘灌入该妇女胃内,一段时间后有胃液分泌;若阻断神经联系,食物在胃内仍能引起少量胃液分泌,该实验结果说明 。
(3)有人提出了胃泌素的假说,认为胃黏膜可分泌一种物质--胃泌素,能影响胃液的分泌。请探究胃泌素对胃液分泌的作用。


①主要实验材料和用品:小鼠若干只、0.9%生理盐水、胃黏膜提取液.
②假设_________________________________________________。
③实验步骤
a.把生长发育相同的健康小鼠分成数量相等的甲、乙两组
b.甲组静脉注射一定浓度的胃黏膜液,乙组注射等量的0.9%生理盐水。
c.在相同且适宜的条件下饲养,观察并记录小鼠胃液的分泌状况。
④实验结果预测:
a.如果 ,假设成立。
b.如果 ,假设不成立。
24.(15分)硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O是一种重要化学试剂。某探究性学习小组用除去锌镀层的铁片来制取硫酸亚铁铵,设计流程如下:
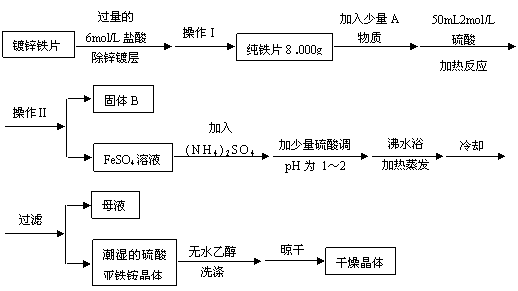

请回答下列问题:
(1)确定锌镀层被除去的标志是 ;
计算上述铁片锌镀层的厚度,不需要的数据是 (填编号)。
a.锌的密度ρ(g/cm3) b.镀锌铁片质量m 1(g) c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2) e.镀锌铁片厚度h(cm)
锌镀层的厚度为 cm(用含ρ、m 1、m 2…等的代数式表示)。
(2)上述流程中:操作Ⅰ是取出铁片、 、 、称量;操作Ⅱ是 。
(3)A物质可以为 (填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 ,B物质的成分为 。
(4)加少量硫酸调节pH为 1-2的目的是 。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是 。
(6)鉴定所得晶体中含有Fe2+、NH4+、SO42―离子的实验方法正确的是 (填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入稀NaOH溶液,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
23.(15分)现有A、B、D、X、Y、Z六种元素,其原子序数依次递增。已知,B、D的氧化物都是汽车尾气的主要有害成分;A、Y是短周期非金属元素,其单质在常温下均为气体。两单质混合见光爆炸生成AY,AY溶液显强酸性。X、Z为常见金属元素,X的原子序数为Z的一半。Z与Y2和A Y溶液反应分别得ZY 3和ZY 2,烧碱溶液不能与Z单质反应,而能与X单质反应。请回答下列问题:
(1)Y的原子结构示意图为 ;X在周期表中的位置是 。
 (2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为
。
(2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为
。
(3)写出X单质与NaOH溶液反应的离子方程式 。

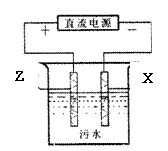
(4)电浮选凝聚法是工业上采用的一种污水处理方法。右图是该方法处理污水的实验装置示意图(X、F金属单质作电极)。实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。阳极的电极反应有两个,分别是4OH--4e-=2H2O +O2↑和 。阳极区生成沉淀的离子方程式是 。
(5)一定条件下,8mol X与3molZ的氧化物W恰好反应,则W的化学式为 ;指出X单质与F的氧化物反应的一种用途 。
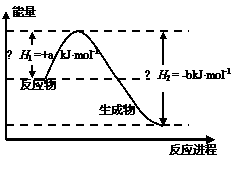
(6)BA4是一种重要能源物质,右图是1.01×105Pa下,1 mol BA4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为 。
22.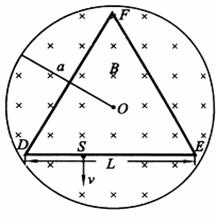 (20分)如题图所示,在半径为a的圆柱空间中(图中圆为其横截面)充满磁感应强度大小为B的均匀磁场,其方向平行于轴线远离读者.在圆柱空间中垂直轴线平面内固定放置一绝缘材料制成的边长为L=1.6a的刚性等边三角形框架ΔDEF,其中心O位于圆柱的轴线上.DE边上S点(
(20分)如题图所示,在半径为a的圆柱空间中(图中圆为其横截面)充满磁感应强度大小为B的均匀磁场,其方向平行于轴线远离读者.在圆柱空间中垂直轴线平面内固定放置一绝缘材料制成的边长为L=1.6a的刚性等边三角形框架ΔDEF,其中心O位于圆柱的轴线上.DE边上S点(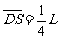 )处有一发射带电粒子的源,发射粒子的方向皆在图题图中截面内且垂直于DE边向下。发射粒子的电量皆为q(>0),质量皆为m,但速度v有各种不同的数值。若这些粒子与三角形框架的碰撞无能量损失,电量也无变化,且每一次碰撞时速度方向均垂直于被碰的边。试问:
)处有一发射带电粒子的源,发射粒子的方向皆在图题图中截面内且垂直于DE边向下。发射粒子的电量皆为q(>0),质量皆为m,但速度v有各种不同的数值。若这些粒子与三角形框架的碰撞无能量损失,电量也无变化,且每一次碰撞时速度方向均垂直于被碰的边。试问:
(1)带电粒子经多长时间第一次与DE边相碰?
(2)带电粒子速度v的大小取哪些数值时可使S点发出的粒子最终又回到S点?
(3)这些粒子中,回到S点所用的最短时间是多少?
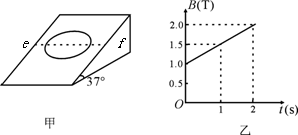
21.(19分)如图甲所示,在一倾角为37°的粗糙绝缘斜面上,静止地放置着一个匝数n=10匝的圆形线圈,其总电阻R=3.14Ω、总质量m=0.4kg、半径r=0.4m.向下轻推一下线圈恰能使它沿斜面匀速下滑。现在将线圈静止放在斜面上后,在水平直线ef(与线圈的水平直径重合)以下的区域中,加上垂直斜面方向、磁感应强度大小按如图乙所示规律变化的磁场,求:
(1)刚加上磁场时线圈中的感应电流大小I;
(2)从加上磁场开始到线圈刚要运动,线圈中产生的热量Q。(最大静摩擦力等于滑动摩擦力,sin37°=0.6,cos37°=0.8,g=10m/s2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com