
离子反应以其常见、覆盖面广、涉及溶液中离子反应规律比较全面以及能考查考生的自学和迁移、联想、组合、对比、判断等思维能力而成为高考的传统试题,保持着良好的区分度。
常见的两个题型是离子反应方程式书写正误判断与离子共存问题。
1、离子反应方程式书写正误判断
错写的离子方程式,近几年高考试题中大致可分为以下几类:
(1)反应不发生或者不符合反应的事实。如:
铁跟盐酸反应: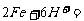

氯化铝溶液中加入过量氨水: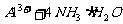
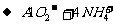
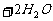
(2)不满足质量守恒或两边阴阳离子所带的电荷守恒。如:
少量金属钠加入到冷水中: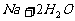
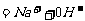
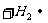 ;
;
氯化亚铁中通入少量氯气: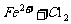

(3)物质写成化学式或是离子形式错误。如:
往碳酸镁溶液中滴加稀盐酸: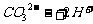
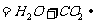
醋酸钠溶液和盐酸混合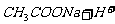
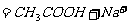
(4)没有注意反应物用量的问题。如:
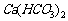 与过量
与过量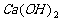 溶液反应:
溶液反应: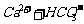

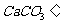
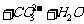
往澄清石灰水通入过量二氧化碳: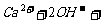
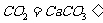
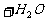
在正确理解原电池和电解池工作原理的基础上,注重在生产中实际应用:金属防护、电镀、精炼、化学能与电能转化的实际意义等。考生尤其应关注近几年高考的热点问题:新型电池(锂电池、铁电池、燃料电池等)。
电化学的难点在于电极反应式的正确书写:
①书写规律:原电池或电解池的两电极反应式之和即为总反应式,对于燃料电池首先写出燃烧反应正确的化学方程式,然后再根据电解液改写燃料电池总反应。
②书写方法:总反应式减去一电极反应式即为另一个电极反应式。对于较复杂的、陌生的反应可用该方法解题并检验,对于燃料电池一般先写出正极的电极反应式(一般较简单)。
③书写注意事项:一看电极材料;二看环境介质;三看附加条件与信息。
近几年高考考查的都是关于化学反应速率和化学平衡的核心知识内容。考生应特别关注近几年多次出现的化学反应速率的综合探究试题:
复习化学反应速率和化学平衡这部分理论知识内容要把握的是理解知识内涵,深入思考。如对化学平衡概念的理解,不死记硬背,而是通过逻辑推理而真正理解化学平衡是动态平衡的含义。对于影响化学反应速率和化学平衡的因素要能通过图表、图象等的绘制分析对比二者的异同和联系。对于理论要点内容,学生通过深入思考后进行认真总结,等效平衡等难点内容做到心中有数。在头脑中形成完整的知识网络。同时要重视理论联系实际,学以致用。要将理论知识的要点与生产、生活实际相联系。如解决合成氨、工业制硫酸等适宜条件的选择。用生产实际条件的选择去加深对理论知识的理解和掌握。
4、氧化还原反应方程式的配平
配平的原则是电子守恒、质量守恒、电荷守恒,配平的思路一般分两部分:第一部分是氧化剂、还原剂、氧化产物、还原产物之间的配平-化合价升降相等或电子得失数相等;第二部分是用观察法配平其他物质的化学计量数。
3、氧化还原反应的相关计算
原理是:氧化剂得到的电子总数等于还原剂失去的电子总数。
2、规律与应用
(1)性质强弱的规律
在“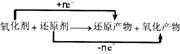 ”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性
”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性
强弱顺序是:还原剂>还原产物。
(2)守恒规律
化合价有升必有降,电子有得必有失.对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子(或共用电子对偏离)总数与得电子(或共用电子对偏向)总数相等。
(3)其他规律:价态表现性质规律,最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性;转化规律,以元素相邻价态间的转化最容易;同种元素不同价态之间的氧化还原反应,化合价的变化遵循“只靠拢,不交叉”(即价态归中);同种元素相邻价态间不发生氧化还原反应;反应先后的一般规律,在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中还原性最强的还原剂作用。
氧化还原反应贯穿于各章元素化合物的知识当中,是化学学科的支柱之一。因此在高考命题中,无论是选择题还是综合题都有关于氧化还原反应的试题。从考查的内容看,有考氧化还原概念的,有写氧化还原反应方程式的,有写氧化还原离子方程式的。突出能力的考查则要联系实际并写出教材中没有学过的氧化还原反应方程式,考氧化还原概念时也多采用学生没有学过的反应。
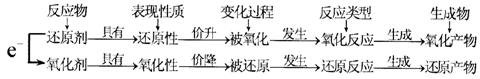
1、相关概念关系:
阿伏加德罗常数受到历年高考选择题的青睐。最为常见的题干都是“NA表示阿伏加德罗常数,下列说法正确的是”。主要考查考生对物质的量、阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗定律等概念清楚辩析、灵活应用。这类题目是以阿伏加德罗常数为载体,考查内容涉及化学基本概念和基本理论、元素化合物甚至化学实验等多方面的知识。每年高考题目关于阿伏加德罗常数考点的设计给考生的感觉熟悉,但在历年高考中都有很好的区分度。考生失分的原因主要是缺少对于基础知识的全面理解和对常考易错点的归纳与概括。
从历年高考题目不难发现,要准确解答此类题目,认真审题是关键。审题重点应该关注的是题干所设置的“陷阱”:
最为常见的是条件陷阱,如气体体积是常温常压下的就不能用标准状况下的气体摩尔体积进行计算,标准状况下所给物质本身不是气态的如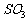 、水、辛烷、
、水、辛烷、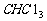 等。但要注意,气体的物质的量、质量与条件无关。如32克氧气无论在常温常压下还是标准状况下都是1摩尔。
等。但要注意,气体的物质的量、质量与条件无关。如32克氧气无论在常温常压下还是标准状况下都是1摩尔。
分子结构陷阱,稀有气体是单原子分子,臭氧是三原子分子,氢气、氮气等是双原子分子。在计算物质所含分子、原子、离子、中子、电子等的数目时应充分考虑物质结构,如过氧化钠中阴离子数目的求算等。
化学反应和隐含平衡的陷阱,如氧化还原反应的实质及电子转移的计算,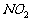 与
与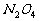
存在的化学平衡,离子的水解、电离平衡等。
只要概念清楚,分析问题会抓住本质,应对阿伏加德罗常数的选择题就会得心应手。
基本概念和基本理论在高考中的赋分比例约40%,虽较以前考纲规定的45%的比例略有降低,但丝毫不影响其作为高考中重大考查对象的地位。
与旧的课程体系相比,在复习中要特别注意新增知识点:难溶物质的溶解平衡、溶度积常数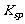 的应用[如09年高考化学广东第18题;福建第24题(5)];平衡常数的计算或应用[如09年高考化学广东省第20题第(3)问;江苏化学的14题;上海化学第17题等];盖斯定律的应用[如09年高考的广东化学第23题(1);江苏化学第17题(2)]。
的应用[如09年高考化学广东第18题;福建第24题(5)];平衡常数的计算或应用[如09年高考化学广东省第20题第(3)问;江苏化学的14题;上海化学第17题等];盖斯定律的应用[如09年高考的广东化学第23题(1);江苏化学第17题(2)]。
知识要点归纳:
32.[现代生物科技专题](10分)
2007年诺贝尔生理学或医学奖授予在“基因靶向”技术方面作出突出贡献的三位科学家。借助这一技术,科学家可以用小鼠进行实验,使其体内的某项特定基因丧失功能,以帮助人们找到治疗疾病的有效方法。下面是该实验的基本过程,请回答有关问题。
(1)获得胚胎干细胞(ES细胞)。实验一般采用ES细胞(或受精卵)作为目的基因的受体细胞,这是因为ES细胞易表现出______________。举出一例获取Es细胞的常用方法: 。
(2)获取目的基因。为了提高实验成功率,还需要通过PCR技术扩增目的基因。与体内DNA复制相比,PCR反应体系需加入哪两种特别的物质?
(3)将基因表达载体导入ES细胞,从中筛选出成功发生了同源重组的ES细胞,然后培育出小鼠。由ES细胞培育出小鼠的过程中,需要用到早期胚胎培养技术和 技术。(4)通过检测目的基因是否表达出蛋白质产品,可以确定该小鼠体内是否成功发生了基因的同源重组。这种检测方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com