
1、掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
归纳总结气体制法原理和典型制取装置:凡由化合物制备气体单质,发生的均是氧化还原反应,如制氢气、氧气、氯气、氮气等。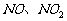 都不是酸酐,都没有对应的酸,要利用硝酸的氧化性来制取。
都不是酸酐,都没有对应的酸,要利用硝酸的氧化性来制取。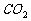 、
、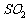 是酸酐,HCl、HF、
是酸酐,HCl、HF、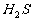 溶于水都是无氧酸,因此这些酸性气体都用酸跟盐的复分解来制取。
溶于水都是无氧酸,因此这些酸性气体都用酸跟盐的复分解来制取。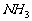 显碱性,利用碱跟盐的复分解反应来制取。
显碱性,利用碱跟盐的复分解反应来制取。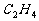 、
、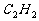 等有机气体依据有机反应原理
等有机气体依据有机反应原理
来制取。应该提高对制法原理的总体认识,同时也要学会分析对于同一气体有哪几种变通的制备方法以及不同的气体还可以用哪些简易的变通装置。
对于气体的收集方法与气体的密度、溶解性、反应等密切相关。除气体杂质选择吸收剂的原则是:所用吸收剂只能吸收杂质气体,而不能与所制气体发生反应;所用试剂是实验室常用试剂,并尽量选择毒性小和便宜的试剂。如除去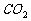 中的HCl、
中的HCl、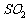 杂质为什么不能用NaOH或
杂质为什么不能用NaOH或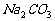 溶液洗气,而用饱和
溶液洗气,而用饱和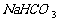 溶液洗气?除去多种气体杂质还要注意顺序。用溶液吸收多数在前,加热固体除杂质、干燥等在后。如除去
溶液洗气?除去多种气体杂质还要注意顺序。用溶液吸收多数在前,加热固体除杂质、干燥等在后。如除去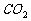 中
中
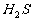 、
、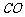 、水蒸气几种杂质气体的顺序是:用
、水蒸气几种杂质气体的顺序是:用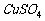 溶液吸收
溶液吸收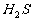 ,用
,用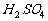 吸收水蒸气,最后用加热的CuO吸收CO。特别需要强调的是:高三复习的后期不能形成思维定势,而应具体问题具体分析:
吸收水蒸气,最后用加热的CuO吸收CO。特别需要强调的是:高三复习的后期不能形成思维定势,而应具体问题具体分析:
物质的检验通常有鉴定、鉴别和推断三类。鉴定通常是指对于一种物质的定性检验,必须根据物质的化学特性,分别检出阴、阳离子;鉴别通常是指对两种或两种以上的物质进行定性辨认,可根据一种物质的特性或特征反应来区别于另一种,也可根据几种物质的气味、状态、颜色、溶解性或溶解时的热效应等一般性质的不同加以区别;推断是通过已知实验事实,根据性质分析推理出被检物质的名称或组成。
熟悉物质的分离与提纯中的基本操作:过滤(沉淀洗涤)、结晶(重结晶)、蒸馏分馏、萃取分液、洗气、渗析、盐析、升华、加热、离子交换等。
物质的分离与提纯的基本操作归纳如下表:
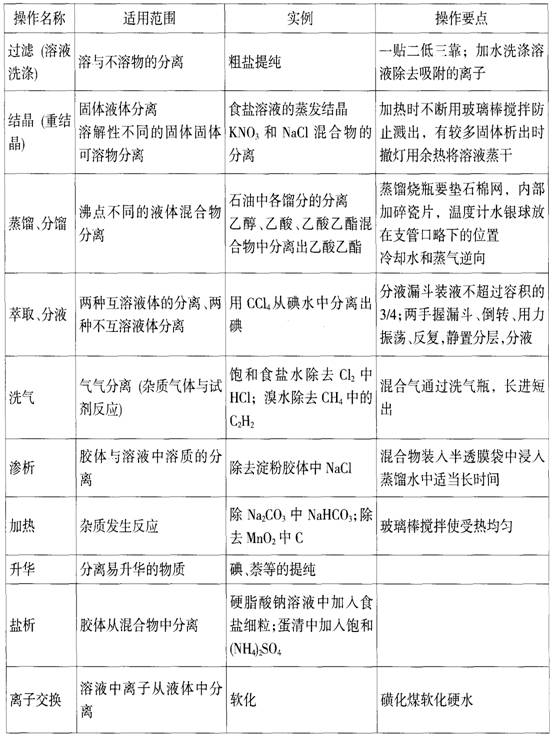
常见物质分离提纯归纳
在实验复习的全过程中领会化学实验是科学探究的一种重要方法,不少高考实验题目直接考查化学实验常用仪器的主要用途和使用方法。只有认真对待课本实验并亲自动手,才能真正掌握化学实验的基本操作。时刻牢记实验安全及常见事故的处理。
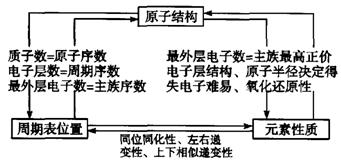
物质结构与元素周期律的试题,是年年必考的内容,通常与元素化合物知识内容的综合题融合在一起。主要考点包括:原子结构、原子半径大小比较、元素周期律、元素周期表的结构和应用。
知识网络如下:
(1)元素“位-构-性”之间的关系
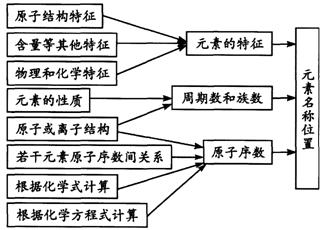
(2)推断元素的名称或在元素周期表中的位置
3、盐类水解
(1)盐类水解的实质:在溶液中盐电离出来的离子跟水所电离出来的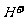 或
或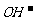 结合生成弱电解质的反应,叫做盐类的水解。
结合生成弱电解质的反应,叫做盐类的水解。
(2)盐类水解的结果:促进水的电离,影响了溶液的酸碱性。
(3)影响盐类水解的因素:内因、外因(温度、浓度、溶液的酸碱性等)
(4)盐类水解的应用
注意以下三个方面:
利用水解:如泡沫灭火器原理、明矾净水、纯碱溶液能去污、氯化铵溶液能除锈等。
抑制水解:如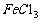 、
、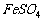 等配制时加酸或在酸中溶解;在HCl气流中使
等配制时加酸或在酸中溶解;在HCl气流中使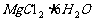
脱水制无水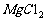 。
。
考虑水解:如分析盐溶液离子浓度、酸碱性;化肥混施;盐溶液浓缩蒸干等。
(5)离子浓度大小的判断
在判断能发生水解的盐溶液中离子浓度大小时,首先要明确绝大部分可溶盐完全电离,电离出的弱电解质离子部分水解(电离强烈、水解微弱);其次要知道多元弱酸分步电离,故其对应盐的水解也是分步进行的,以第一步水解为主;最后还要考虑水的电离。解题时把握好三种守恒:物料守恒、电荷守恒和质子守恒。
(6)酸碱中和滴定
熟悉中和滴定的原理和实验操作、图表绘制与数据分析等,关键是能够运用这一定量实验的方法培养自学能力:氧化还原滴定、沉淀滴定法等在在具体试题中的应用。
2、混合溶液的pH计算
题设条件从数字到字母等条件变换多,但基本题型只有两种:(1)混合后不反应,(2)混合后反应。对于溶液的稀释,可将水作为浓度为0的溶液,仍属混合后不反应一类,这一类混合溶液的pH应介于两种溶液的pH之间,因而酸、碱溶液无论加多少水稀释,其最终pH均不可能等于纯水的pH(即常温不可能为7)。混合溶液pH的计算方法也很简单,即设法求出混合溶液的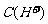 若是溶液显碱性,则必须先求出溶液的
若是溶液显碱性,则必须先求出溶液的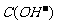 ,然后再换算为
,然后再换算为
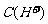 或按
或按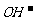 量守恒列式求解。
量守恒列式求解。
电离理论的重要考点包括:水的电离和离子积常数;溶液pH的定义及测定溶液pH的方法,能进行有关pH的简单计算;弱电解质在水溶液中的电离平衡;影响电离平衡的因素、酸碱电离理论;盐类水解的原理及影响盐类水解程度的主要因素、盐类水解的应用等。
1、酸碱盐对水的电离平衡的影响

难溶电解质在水中的溶解存在沉淀溶解平衡的特点,掌握溶度积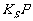 的概念并能简单的利用
的概念并能简单的利用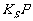 的表达式计算溶液中相关离子的浓度,尤其是运用浓度商和平衡常数来分析沉淀的溶解、生成和沉淀的转化。特别要关注的是沉淀溶解平衡常数,已经成为新课程高考的新宠。
的表达式计算溶液中相关离子的浓度,尤其是运用浓度商和平衡常数来分析沉淀的溶解、生成和沉淀的转化。特别要关注的是沉淀溶解平衡常数,已经成为新课程高考的新宠。
2、离子共存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com