
24.(11分)为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案。
已知:2Na2O2+2CO2=== 2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度。

(1)C中所盛的药品是: 。
(2)A中橡皮管的作用是: 。
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是 (填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙:称取3.500 g试样,配成1000.00 mL溶液,用0.1000 mol·L-1的标准盐酸滴定。
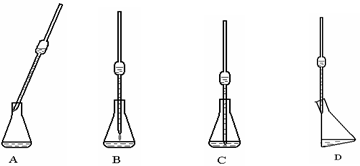
(4)取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,取溶液所用仪器的名称是 。
(5)滴定操作平行实验的数据记录如下表:
|
滴定次数 |
第一次滴定 |
第二次滴定 |
第三次滴定 |
|
消耗标准盐酸的体积(mL) |
24.98 |
25.00 |
25.02 |
由表中数据计算样品中Na2O2纯度为 。
23.(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
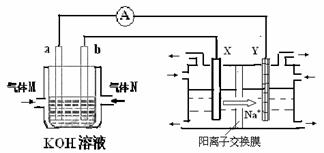
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)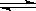 2NH3
(g) ΔH=-92.2kJ·mol-1
2NH3
(g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2 、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④ 用N2、H2 、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
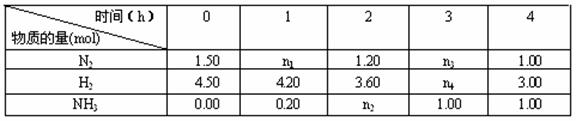
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
22.(10分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
A 甲+H2O 乙+丙 B 乙
乙+丙 B 乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表里的位置是_____________。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为__________。
③将以上两种金属单质用导线连接,插入NaOH溶液构成原电池,则负极发生的电极反应为___________________________。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①甲的结构式为_____________。
②写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式________________________。
21.(8分)回答下列有关问题:
(1)硫化铵水解的离子方程式为:S2-+NH4++H2O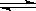 HS-+
NH3·H2O,
HS-+
NH3·H2O,
如何判断溶液的酸碱性: 。
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: 。有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请你运用所学知识解释:
。
(3)用离子方程式解释泡沫灭火器(将硫酸铝与碳酸氢钠溶液混和)灭火原理:
。
Ⅱ 卷
20.下列反应的离子方程式书写正确的是
A. NaHSO3溶液显酸性是因为:HSO3-+H2O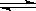 SO32-+H3O+
SO32-+H3O+
B. CO2与Ca(OH)2溶液以反应物物质的量之比2∶1反应:CO2 +OH-=HCO3-
C. 往KAl(SO4)2溶液加入Ba(OH)2溶液至SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D. 往苯酚钠溶液中通入少量CO2:
2 -O-+CO2 +H2O→2
-O-+CO2 +H2O→2 -OH+CO32-
-OH+CO32-
宁波市二00九学年度第二学期八校联考化学答题卷
19.已知298K时,N2(g)+3H2(g)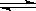 2NH3(g) ΔH=-Q
kJ·mol-1.在相同条件下,向密闭容器中加入1
molN2和3 molH2,达到平衡时生成0.2molNH3放出的热量为Q1
kJ,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2
kJ,若向相同容积的另一密闭容器中通入2molNH3,达到平衡时吸收的热量为Q3kJ。则下列关系式正确的是:
2NH3(g) ΔH=-Q
kJ·mol-1.在相同条件下,向密闭容器中加入1
molN2和3 molH2,达到平衡时生成0.2molNH3放出的热量为Q1
kJ,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2
kJ,若向相同容积的另一密闭容器中通入2molNH3,达到平衡时吸收的热量为Q3kJ。则下列关系式正确的是:
A.Q>Q1>Q2>Q3 B.Q= Q1+ Q3 C.Q>Q1+ Q3 D.Q>Q3>Q1>Q2
18.有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是:
A .PH:②>③>④>① B. C(CH3COO-):②>④>③>①
C. 溶液中C(Na+):①>③>②>④ D. C(CH3COOH):①>④>③>②
17.在水电离出来的氢离子浓度为10-13mol/L的溶液中,下列各组离子一定不能大量存在的是
A. Na+、NO3-、Al3+、K+ B. Na+、ClO3-、ClO-、ClO4-
C. K+、Cr2O72-、I-、Na+ D. Na+、S2O32-、SO42-、NH4+
16.向体积为Va的0.05mol/L CH3COOH溶液中加入体积为Vb的0.05mol/LKOH溶液,下列关系错误的是:
A. Va>Vb时:C(CH3COOH)+ C(CH3COO-)>C(K+)
B. Va=Vb时:C(CH3COOH)+ C(H+)== C(OH-)
C. Va<Vb时:C(CH3COO-)>C(K+)>C(OH-)>C(H+)
D. Va与Vb任意比时:C(K+)+C(H+)==C(OH-)+C(CH3COO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com