
35.(3分)
(1)2.2 g (1分)
(2)
[解] 设原混合物中碳酸钠的质量为x,参加反应的硫酸的质量为y,生成的硫酸钠的质量为z。
Na2CO3+ H2SO4===Na2SO4+CO2↑+H2O
106 98 142 44
x y z 2.2 g
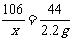 x=5.3g
x=5.3g
|
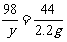 y=4.9g
y=4.9g
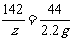 z=7.1g
z=7.1g
设所加稀硫酸的质量为m。
|
|
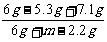 ×100% = 19.5 % m=36.2 g
×100% = 19.5 % m=36.2 g
则所加稀硫酸的溶质质量分数为: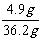 ×100% = 13.5 %
×100% = 13.5 %
答:所加稀硫酸的溶质质量分数为13.5%。
通州
35.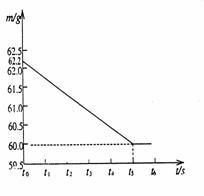 (3分)将碳酸钠和硫酸钠的固体混合物6g,放入烧杯
(3分)将碳酸钠和硫酸钠的固体混合物6g,放入烧杯
中,再加入一定量的稀硫酸,在一定时间内恰好完全反应,无固体剩余,所得溶液溶质质量分数为19.5%,反应的时间(t)和烧杯及其所盛物质总质量(m)的关系如右图所示:
(1)生成气体的质量为 。
(2)求所加稀硫酸的溶质质质量分数。
35.(3分)
(1)B ┈┈┈┈┈┈┈┈(1分)
(2)设样品中锌的质量为x,生成的硫酸锌的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑
65 161 2
X y 0.4g
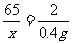
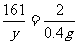
X=13g y=32.2g
Cu的质量分数为 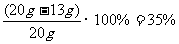 ┈┈┈┈┈┈┈ (1分)
┈┈┈┈┈┈┈ (1分)
(3)所得溶液中生成物的溶质质量分数为  ×100% = 20%
×100% = 20%
┈┈┈┈┈┈┈ (1分)
答:样品中铜的质量分数为35%,反应后所得溶液中硫酸锌的质量分数为20%。
大兴区
35.(3分)研究性学习小组为了测定黄铜(铜、锌合金)的组成,用电子天平分别称得锥形瓶与棉花的质量为44.1g,称取黄铜样品20.0g。在锥形瓶中加入该样品和足量稀硫酸后瓶口塞上棉花,如图1所示。将电子天平称量的数据绘成下图2。
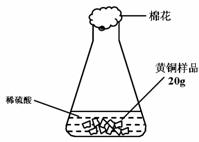
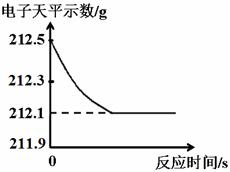
图1 图2
请认真分析数据,回答下列问题:
(1)四个同学从多角度处理数据,下列数据处理的图像中正确的是 。
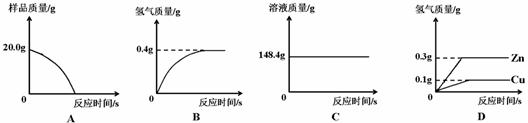
(2)试计算:
①样品中铜的质量分数;
②恰好反应时所得溶液中生成物的质量分数。
35.(1)1.8g(1分)
(2)算出样品完全反应时,产生CO2的质量为4.4 g ………(1分)
解:设生成4.4 g CO2,需碳酸钠的质量为x
Na2CO3 + 2HCl == NaCl + H2O + CO2↑
106 44
x 4.4
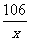 =
= 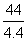
x=10.6
Na2CO3%=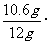 100℅=88.3%
100℅=88.3%
∵96℅>88.3℅ ∴该产品中Na2CO3的质量分数不合格 ………(1分)
丰台区
35.(朝阳区)(3分)某化工厂用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取12g纯碱样品放入烧杯中,称得烧杯及纯碱样品的总质量为158g,再把100g稀盐酸平均分成四份,依次加入到样品中,每次均充分反应。实验数据记录如下:
|
所加盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
盐酸的质量/g |
25 |
25 |
25 |
25 |
|
烧杯及所盛物质总质量/g |
181.2 |
204.4 |
228.6 |
253.6 |
请计算:(要求计算过程)
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该产品中碳酸钠的质量分数是否合格?
35.(3分)(每个过程和结果均正确得1分,过程和结果有一项不正确不得分。)
|
|
|
(3)20%
35.取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水)。设该样品中的杂质既不与稀盐酸反应也不溶于水。试计算:(写出计算过程,计算结果保留一位小数)
(1)该反应中生成的气体的质量。
(2)参加反应的盐酸的质量。
(3)反应后所得溶液中溶质的质量分数。
22. 3 g +216.1 g -44X/106
3 g +216.1 g -44X/106
X = 10.6 g ---------1分
(2)原混合物固体中氯化钠的质量=(22.3-10.6)g =11.7 g
钠元素和氯元素的质量比
=(10.6×46/106 + 11.7×23/58.5)g:(11.7×35.5/58.5 + 216.1×10%×35.5/36.5)g
= (4.6+4.6)g:(7.1+21.0)g
= 9.2g:28.1g
= 92:281 ---------------1分
答:原固体混合物中碳酸钠的质量10.6克;A点时溶液中钠元素和氯元素的质量比为92:281 。
(海淀)
22.3-X) g + 117X/106
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com