
35. (3分)甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应后得到沉淀及有关实验数据如下表:
|
4位同学的实验 |
甲 |
乙 |
丙 |
丁 |
|
加入氢氧化钠溶液质量 (g) |
29.0 |
34.5 |
40.0 |
45.0 |
|
反应得到沉淀的质量 (g) |
2.1 |
2.5 |
2.9 |
2.9 |
反应的化学方程式为:MgCl2+2NaOH→Mg(OH)2↓+2NaCl,试回答下列问题: (1)恰好完全反应的是_______同学的实验。 (2)计算样品中所含氯化镁的质量分数(写出计算过程,结果精确到0.1%,下同)。 (3)计算丙同学实验后所得溶液中的氯化钠的质量分数。
115.44g+z)16%=26.44g
Z=49.81g≈49.8g
答:需要加水质量约为49.8g
延庆县
35.(3分)
(1) 36.48 g。
(2)
解:每20克稀盐酸反应后产生MCO2 =20g+20g-38.24g=1.76g
设每20克稀盐酸可消耗Na2CO3质量为x ,生成NaCl质量为y
Na2CO3+2HCl→2NaCl+H2O+CO2↑
106 117 44
X y 1.76g
X=4.24g y=4.68g
纯碱中杂质NaCl=20g-4.24g×4=3.04g
所得溶液中NaCl总质量=4.68g×5+3.04g=26.44g
所得溶液中NaCl溶液总质量=20g+100g+4.24g-1.76g×5=115.44g
所得溶液中NaCl溶质质量分数=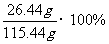 =22.90%
=22.90%
设配成16%氯化钠溶液需加水质量为Z.
35.(3分)现有一瓶纯碱样品其中含有少量NaCl杂质,课外化学小组同学将100g盐酸分5次加入到20g纯碱样品中,得到如下部分数据和图象(假设产生的气体全部逸出)。
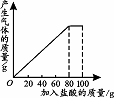
|
次数 |
第1次 |
第2次 |
第3次 |
|
加入盐酸的质量/g |
20 |
20 |
20 |
|
烧杯中剩余物的质量/g |
38.24 |
a |
74.72 |
请计算:
(1)第2次加入盐酸后, a为___▲____g。
(2)16%的NaCl溶液可用于生物小组进行选种。欲将第5次实验后的溶液配成16%的NaCl溶液,可先向此溶液中加入适量的碳酸钠粉末,至无气泡产生为止,这时还需要向溶液中加入水多少克?(假设实验过程中溶液损失忽略不计)
35.(3分)
解:设稀盐酸中所含溶质的质量为x
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106 73 117 44
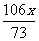 x
x
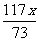
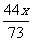 …………………………1分
…………………………1分
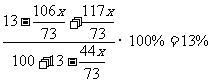 ……………………………………………………1分
……………………………………………………1分
X=7.4g
C%=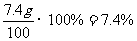 ……………………………………………………………1分
……………………………………………………………1分
平谷区
35.(3分)“冬捞夏晒”得到的纯碱中含有部分食盐。现取这种纯碱样品13g与100g稀盐酸恰好完全反应,测得所的溶液中溶质的质量分数为13%。则反应所用稀盐酸的质量分数是多少?
35. 解:(1)设该生铁样品中单质铁的质量为x
样品的质量=102.4g -70.4g=32 g
H2的质量=(102.4g+247.3g)- 348.7g =1 g …………………………1分
Fe + H2SO4 FeSO4 + H2 ↑
56 2
x 1g
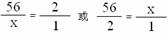
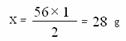
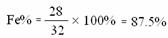 …………………………1分
…………………………1分
(2) 设Fe3C的质量为y
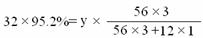
y=2.64 g
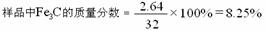 …………………………1分
…………………………1分
答:该生铁样品中单质铁的质量分数为87.5%;样品中Fe3C的质量分数为8.25%。
顺义区
35.(3分) 化学兴趣小组对生铁样品中铁的质量分数进行探究。
[查阅资料]生铁中除铁外,还含有碳、硅、磷和硫等元素。碳在生铁中以两种形式存在:一种是单质碳(C),另一种是化合碳(如Fe3C);硅、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
[实验数据]
|
|
烧杯 |
烧杯+生铁样品 |
稀硫酸 |
烧杯+剩余物质 |
|
质量/g |
70.4 |
102.4 |
247.3 |
348.7 |
请计算:(1)该生铁样品中单质铁的质量分数;
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%(假设没有与硫酸反应的铁都是以Fe3C形式存在),求样品中Fe3C的质量分数。
35.(3分)
(1)120
(2)解:设水垢中碳酸钙的质量为x
CaCO3 + 2HCl = CaCl2 + H2O +CO2↑ ………………1分
100 44
 x
66g
x
66g
|
||
|
答:略。
昌平
35.(3分)长久使用的热水壶内都会有一层水垢,已知其主要成分是碳酸钙和氢氧化镁,用稀盐酸可以清除这些水垢。某校化学课外活动小组同学在测定水垢中碳酸钙的含量时,在200g水垢中加入足量的稀盐酸,并同时测量了3分钟内产生气体的质量,有关数据如下:
|
时间/s |
0 |
30 |
50 |
90 |
120 |
150 |
180 |
|
气体质量/g |
0 |
30 |
50 |
60 |
80 |
66 |
66 |
请回答下列问题:
(1)表中有一项测量结果有较大的误差,其对应的时间是 ▲ 。
(2)水垢中碳酸钙的质量分数是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com