
1.下列生产、生活中的做法正确的是
A.将垃圾就地焚烧 B.食用水果补充维生素
C.随意丢弃塑料袋 D.在牛奶中添加三聚氰胺
23.浓H2SO4和木炭在加热时发生反应的化学方程式是 2H2SO4(浓)+C  CO2↑+2H2O+2SO2↑。
CO2↑+2H2O+2SO2↑。
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)



将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22.(6分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为 g/mol(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体为6.5L,其中臭氧为
L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g,则原混合气体中臭氧的体积分数为 。
21.(9分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
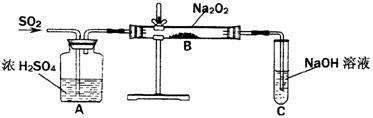
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是: 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3 。
(3)第2小组同学认为Na2O2与SO2反应生成了Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?______________________。请简要说明理由:
① ;② 。
20.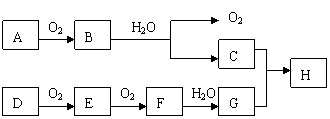 (6分)在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。
(6分)在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。
试回答:(1)写出下列物质的化学式:A_________、G_________。
(2)写出C的电子式______________。
(3) 写出E→F的化学反应方程式_______ __________________。
19.(10分)在很长的一个历史时期,人们一直认为氟的含氧酸不存在。1971年美国科学家将氟气通过细冰末获得次氟酸(HFO),此后对次氟酸的研究引起充分的重视。试回答:
(1)写出次氟酸的结构式 ;
(2)次氟酸能与水反应得到溶液A,A中含B、C两种溶质。B可用于雕刻玻璃,C在MnO2催化作用下能迅速分解生成能使带火星木条复燃的气体。则次氟酸与水反应的化学方程式为 ;
某课外化学小组探究C的性质,该化学小组根据所提供的实验条件设计了两个实验,分别证明了C的氧化性和不稳定性。(实验条件:试剂只有C的溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实验内容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
(3)近几年前,我国部分地区出现了“非典型性肺炎”,为了预防“非典型性肺炎”加强环境卫生已成为人们的共识,请你列举常用于环境消毒的化学药品两种为 。
18.[平行班做](10分)下表是元素周期表的一部分, 针对表中的①-⑨种元素,填写下列空白:
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号)。原子结构示意图为_____________________ 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是_______,碱性最强的化合物是____________。
(3) 最高价氧化物是两性氧化物的元素是_____ ____;写出它的氧化物与氢氧化钠反应的化学方程式_____ _________ _________ _________ __________。
(4) 用电子式表示元素⑥与④的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。①和⑥形成化合物的结构式: 。
18.[火箭班及尖子班做](10分)(1)下表中的实线是元素周期表部分边界,请在表中用粗实线补全元素周期表边界,并同时也用粗实线划出金属元素与非金属元素的分界线。

(2)元素周期表是学习化学的重要工具,它含有许多信息和规律。下表所列是五种短周期的原子半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/m |
0.16 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
用元素代号在表(1)中标出它们在周期表中对应位置。
(3)上述A、B、E所代表元素的离子半径最大的为 (填离子符号)
(4)周期表有些元素存在“对角线相似”现象,请写出D的单质与NaOH强碱溶液生成Na2DO2 (D为元素代号)和H2反应的离子方程式 。
17.(8分)黄铜矿(主要成分为CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的有关反应为:8CuFeS2+21O2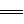 8Cu+4FeO+2Fe2O3+16SO2。已知在CuFeS2中Fe的化合价为+2,则该冶炼铜的反应中被氧化的元素_____(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。已知在CuFeS2中Fe的化合价为+2,则该冶炼铜的反应中被氧化的元素_____(填元素符号)。
(2)上述冶炼过程中会产生大量SO2。下列处理方案中不合理的是______(填字母代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制取Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2,有关离子方程式为:
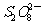 +2I-
+2I-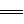 2
2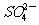 +I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。Fe3+对上述反应的催化过程(Fe3+参与反应)用离子方程式可表示_______ ___
__、_________________________________ ___.。
+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。Fe3+对上述反应的催化过程(Fe3+参与反应)用离子方程式可表示_______ ___
__、_________________________________ ___.。
16.(6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是: 和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com