
2.In the countryside, _______ car is not yet _______ popular means of transportation.
A. the, a B. a, the C. the, the D. a, a
第一节:单项选择(共20小题,每小题0.5分,满分10分)
1.一Thank you ever so much for your timely help. 一__________.
A.Glad to hear that B.With pleasure C.Think nothing of it D.All fight
19、利用中和反应可以测定酸或碱溶液中溶质的质量分数。例如,在一定量的待测酸(或碱)溶液中逐滴滴入已知质量分数的碱(或酸)溶液(这种溶液被称为标准溶液),直到酸、碱恰好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的溶质质量分数。
右下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图。
(1)根据右下图曲线可以判断在实验中是向________(填“酸”或“碱”,下同)溶液(待测液)中滴加________________溶液(标准液)。
(2)在这次测定中,为了指示中和反应刚好完全,有酚酞做指示剂,即在待测溶液中先滴入几滴酚酞试液,若看到____________________________________现象,则证明中和反应刚好完全。
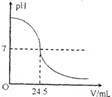 (3)如果实验中使用的酸是硫酸溶液,碱是氢氧化钠溶液,且待测液和标准液的密度均为1.0g/cm3计。若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。(计算过程中数值保留至0.1)。
(3)如果实验中使用的酸是硫酸溶液,碱是氢氧化钠溶液,且待测液和标准液的密度均为1.0g/cm3计。若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。(计算过程中数值保留至0.1)。
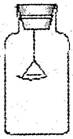
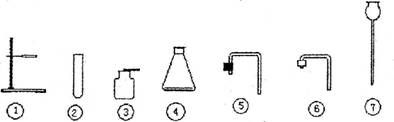 17、(10分)下列是实验室常用仪器的示意图。
17、(10分)下列是实验室常用仪器的示意图。
(1)写出仪器名称:①______________________________
(2)实验室制取二氧化碳的反应化学方程式是_________________________________。
(3)请用上图所示的仪器组装一套制取二氧化碳的装置(填编号):_____________。
(4)检查你设计的装置气密性的方法是:_________________________________________________ ___________________________________________________________________________。
(5)请你对自己设计的装置从操作的简便性和制得二氧化碳的量作出评价:________________ ___________________________________________________________________________。
(6)你设计的装置用来制取氧气,其对应的反应化学方程式是:
______________________________________________________________________。
18、(10分)某化学课外兴趣小组通过查阅资料知道过氧化钠(Na2O2)能与水反应生成氢氧化钠和氧气,于是他们做了以下探究实验。向盛有过氧化钠粉末的试管中加入水,充分反应后,取试管中的少量溶液放入另一小试管中加入几滴无色酚酞试液,溶液变红,过了一会,红色又褪去了。
[提出问题]溶液为什么先变红,过了一会,红色又褪去了。
[猜想]甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故。乙同学认为甲同学的猜想不正确,理由是___________________________________________________________________________________________ ________________________________________________________________________。
[查阅资料]①滴加酚酞呈现红色的溶液遇到H2O2时,H2O2可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;②酚酞在稀碱性溶液中稳定显红色,而在浓氢氧化钠等溶液中显红色后又褪色。
[猜想]通过查阅资料后,该兴趣小组对溶液的红色褪去的主要原因进行了猜想。猜想A:过氧化钠与水反应可能生成了H2O2;猜想B:生成的氢氧化钠溶液可能太浓。
[实验探究]请你将下列实验方案填写完整。
|
猜想 |
实验操作 |
预期实验现象和结论 |
|
A |
|
|
|
B |
|
|
[拓展]若猜想A是正确的,则根据实验分析,过氧化钠与水反应除了生成氢氧化钠和氧气外,还存在另一反应,则另一反应的化学方程式为_____________________________。
15、(5分)在生活和化学实验中,人们经常用到各种除湿剂(干燥剂)。
(1)硅胶。无色或白色颗粒,吸水量为30%~35%,可反复使用。其主要成分可看作是SiO2,其中Si元素的化合价为_________________。
(2)生石灰。白色块状固体,吸水后生成熟石灰,该反应的化学方程式为____________ ______________________________________________________________________。
(3)无水氯化钙。白色固体,有苦咸味,每千克吸水量为1Kg~1.2Kg。若1Kg无水氯化钙吸收1.2Kg水后得到氯化钙溶液,该溶液中溶质的质量分数为____________%(计算结果保留小数点后一位数字)。
(4)浓硫酸。无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它作除湿剂。其原因是_____________________________________________ (写出一条即可)。
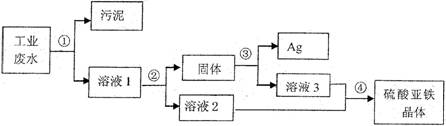 16、(10分)有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。方案流程如下:
16、(10分)有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。方案流程如下:
回答下列问题:
(1)步骤②中:需加入的物质是______________,分离所得混合物的方法是_____________________ _________________________________________________________________。
(2)步骤③中:需加入的物质是______________,发生反应的化学方程式是_______
___________________________________________________________________。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?______________,理由是__________________________________________
__________________________________________________________________________。
(4)步骤④的溶液2和溶液3为什么要混合?_____________________________________________ ________________________________________________________________________。
14、(10分)下面是初中常见化学概念之间的相互关系。
(1)根据下列物质分类表,请写出以Na、H、O、S等元素组成的与表中物质类别不同的化学式,填在相应的空格里。
(2)下表列出了部分元素的原子结构示意图。请回答下列问题:
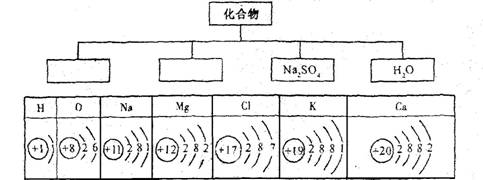 钙原子的核内质子数为_______________,镁原子的最外层电子数为_____________,氯原子在化学反应中易___________(填“得”或“失”)电子,钾元素和氧元素所组成化合物的化学式为_________。
钙原子的核内质子数为_______________,镁原子的最外层电子数为_____________,氯原子在化学反应中易___________(填“得”或“失”)电子,钾元素和氧元素所组成化合物的化学式为_________。
 (3)锌在干燥空气中很稳定,在潮湿空气中,容易发生反应,其反应的方程式可以表示为:4Zn+2O2+3H2O+X====3Zn(OH)2+ZnCO3。则X的化学式为____________。
(3)锌在干燥空气中很稳定,在潮湿空气中,容易发生反应,其反应的方程式可以表示为:4Zn+2O2+3H2O+X====3Zn(OH)2+ZnCO3。则X的化学式为____________。
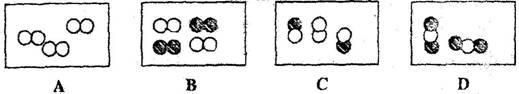
(4)下图是表示气体分子的示意图,图中 分别表示两种不同的原子,其中表示化合物的是__________,表示混合物的是_________,表示单质的是_______。
13、(7分)雨水资源化是一种发展趋势,2008年奥运会所使用的奥运场馆都建立了雨水
利用系统,大大提高了雨水利用率。
(1)正常雨水的pH约为5.6,因为空气中的CO2与水发生反应,写出该反应
的化学方程式________________________________________________________________________。
(2)雨水在降落过程中常受NO2、SO2的污染形成酸雨,空气中的SO2主要来源于______ _____________;若要测定某雨水的酸度是否属于酸雨,可使用__________________来测定。
(3)收集的地面雨水常携带树叶、塑料袋等不溶杂物,处理雨水时应进行沉降、______,为了使主要受SO2污染的酸雨被回收利用,必须对其酸性进行中和,你认为以下较为经济有效的方法是加入适量的_________固体(填序号)。
A、NaOH B、Ca(OH)2 C、CaCl2 D、Na2CO3
(4)下列措施不能减少酸雨的是___________(填序号):
①推广清洁能源 ②减少用煤直接作燃料 ③淘汰尾气不达标的汽车
④限制燃放烟花爆竹 ⑤限制并有偿使用塑料袋
12、(4分)把一个小铃通过细线固定在盛满CO2的集气瓶中,向瓶中倒入NaOH溶液,
迅速塞紧并轻轻振荡,过一会儿,再摇动集气瓶,只看到小铃的振动,却听不到铃声。试回答:
(1)写出瓶内发生反应的化学方程式:_____________________________________。
(2)听不到铃声的原因是_________________________________________________。
11、(6分)用数字和化学符号填空
(1)铁与过量盐酸反应,溶液中的溶质______________(2)保持水的化学性质的最小粒子_________
(3)2个氯离子______________________________ (4)1个氮分子_____________________________
 (5)氧化铝中铝的化合价为+3价________________ (6)含有钙元素的碱__________________________
(5)氧化铝中铝的化合价为+3价________________ (6)含有钙元素的碱__________________________
10、自来水常用二氧化氯(ClO2)来杀菌消毒,它能转化为可溶性氯化物。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,你想选用的化学试剂是( )
A、氯化钡溶液 B、石蕊试液 C、硝酸银溶液 D、氢氧化钠溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com