
第Ⅰ卷(选择题,共54分)
可能用到的相对原子质量:H:1 O:16 S:32 Ba:137
说明:(1)考试过成中不允许用计算器
(2)看清个别题分平行班做和实验班做
2. 已知金属钠和水能发生下列反应:2Na + 2H2O 2NaOH + H2↑,现将一定质量的金属钠放入75.6克水中,反应后生成8克氢氧化钠,计算:
已知金属钠和水能发生下列反应:2Na + 2H2O 2NaOH + H2↑,现将一定质量的金属钠放入75.6克水中,反应后生成8克氢氧化钠,计算:
(1)参加反应的水是多少克?
(2)反应后得到的氢氧化钠溶液中溶质的质量分数是多少?
1、在88.4克水中加入某胆矾与氢氧化钠的混合物16.5克。发生反应:
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,若恰好完全反应,生成沉淀4.9克。求:
(1)反应中CuSO4和NaOH的质量比。
(2)此固体混合物中胆矾的质量。
(3)反应完成后溶液中溶质的质量分数
2、.用铁片、铜片、硝酸汞溶液和盐酸四种物质,验证Fe、Cu、Hg的金属活动性顺序,有如下三种实验方案(选项中Fe+HCl表示将铁片加入盐酸中,Fe+Hg(NO3) 2表示铁片加入硝酸汞溶液中,其它有关文字说明省略)
A.Fe+HCl Cu+HCl Cu+Hg(NO3) 2 B.Cu+HCl Cu+Hg(NO3) 2 Fe+Hg(NO3) 2 Fe+HCl
C.Fe+HCl Cu+Hg(NO3) 2 Fe+Hg(NO3) 2
1.利用纯净、干燥的氢气还原灼热的氧化铜来测定水的组成。实验装置由A、B、C、D、E组成,如下图:


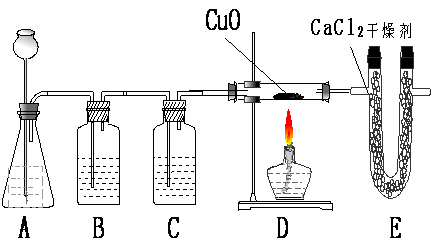
请回答下列问题:
①如果某学生用锌和较浓的盐酸制取氢气,他用装置B、C是为了得到纯净、干燥的氢气,他在装置B中通常盛放 溶液,为了除去 ;在装置C中盛放的试剂应是 ,为了除去 。
②若实验前后,称量结果如下:装氧化铜的玻璃管的质量减少了6.4g,装氯化钙U形管的质量增加了7.2g,根据上述实验数据写出水中氢、氧俩种元素质量比的原始计算式 。
③在装置E中,将CaCl2改变为 ,才能检验出氢气还原氧化铜有水生成。
9.酸雨是指pH<5.6的雨、雪等各种形式的大气降水。它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成的。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。
某校化学兴趣小组同学,取刚降到地面的酸雨水样,每隔一定时间测定其pH,数据如下:
|
测定时间(分钟) |
0 |
1 |
2 |
3 |
|
pH |
4.73 |
4.62 |
4.56 |
4.55 |
(1)从测定的数据可知;在测定的4分钟内酸雨水样的酸性是 (填“减弱”或“增强”)。
(2)在测定的时间内,酸雨水样pH发生变化的主要原因是:酸雨中的亚硫酸(化学式是H2SO3)被空气中的氧气氧化为硫酸的缘故。请写出反应的化学方程式:
8、一杯待过滤的液体,是搅拌均匀后一次过滤好呢?还是等静置澄清后分上层清液,下层浊液两次过滤好呢?为什么?
7、巳知氨气(NH3)的密度比空气小,易溶于水。 氨气是工业上生产硝酸的重要原料,在一定条件下氨气与氧气反应生成一氧化氮和水,一氧化氮与氧气反应生成二氧化氮、二氧化氮被水吸收生成硝酸和一氧化氮。试回答:实验室制取氮气采用什么方法收集?并写出工业生产硝酸的各步反应的化学方程式__________________。_____________ 是还原剂。
6、试从分子、原子、元素的角度说明水的组成和构成.
5、炼铁时,进风口处焦炭跟氧气反应生所________________。该气体上升,跟炉腹中的炭层发生反应生成___________________,此气体上升到炉身,在高温条件下与氧化铁反应的化学方程式为 _____________ ,其中___________被还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com