
5.关于内环境稳态调节机制的现代观点是
A.神经调节 B.体液调节 C.神经-体液调节 D.神经-体液-免疫调节
4.下列有关稳态生理意义的叙述,错误的是:
A.稳态有利于酶促反应的正常进行
B.稳态是机体进行正常生命活动的必要条件
C.当稳态遭到破坏是,可导致疾病发生
D.当血液的成分稳定时,人一定不会发生疾病
3.人剧烈活动后,隔一段时间血浆的pH会:
A.大于7.35-7.45 B.远小于7.35-7.45
C.维持在7.35-7.45 D.稳定在3-4
2.除哪项外,均为内环境概念的要素: ( )
A.细胞内液 B.主要组成为血浆、组织液和淋巴
C.细胞外液 D.体内细胞赖以生存液体环境
1.人体血浆中不可能出现的是 [来
A.葡萄糖 B.激素 C.氨基酸 D.血红蛋白
22.(16分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?

21.(11分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
(填字母。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+ H2(g) △H=64.39KJ·mol-1
2H2O2(l)=2H2O(l) + O2(g) △H= -196. 46KJ·mol-1
H2(g) +  O2(g) = H2O(l) △H= -285. 84KJ·mol-1
O2(g) = H2O(l) △H= -285. 84KJ·mol-1
在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3 .0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
20.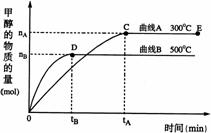 (13分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(13分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)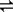 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
19.(9分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ写出该反应的热化学反应方程式: 。若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g)+1/2O2(g)=H2O(g)的△H= kJ·mol-1。氢气的燃烧热为 kJ·mol-1。
18.(3分)稀氨水中存在电离平衡:NH3 + H2O 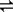 NH3•H2O
NH3•H2O
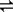 NH4+ + OH-
NH4+ + OH-
试分析向溶液中分别加入下列物质时,平衡如何移动:
|
加入的物质 |
氯化铵 |
氨气 |
氢氧化钠 |
|
平衡移动方向 |
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com