
2.指数:
(1) 规定:
① a0= (a≠0); ② a-p= ;
③ 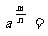 .
.
(2) 运算性质:
① 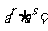 (a>0, r、
(a>0, r、 Q) ②
Q) ② 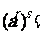 (a>0, r、
(a>0, r、 Q)
Q)
③ 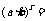 (a>0, r、
(a>0, r、 Q)
Q)
注:上述性质对r、 R均适用.
R均适用.
1.根式:
(1) 定义:若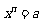 ,则
,则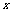 称为
称为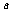 的
的 次方根
次方根
① 当 为奇数时,
为奇数时,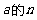 次方根记作__________;
次方根记作__________;
② 当 为偶数时,负数
为偶数时,负数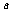 没有
没有 次方根,而正数
次方根,而正数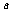 有两个
有两个 次方根且互为相反数,记作________(a>0).
次方根且互为相反数,记作________(a>0).
(2) 性质:
①  ; ② 当
; ② 当 为奇数时,
为奇数时, ;
;
 ③ 当
③ 当 为偶数时,
为偶数时, _______=
_______= 
24、(9分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
(1)已知BA5 为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了
(4)G的价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 _
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是

23. (7分) 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下
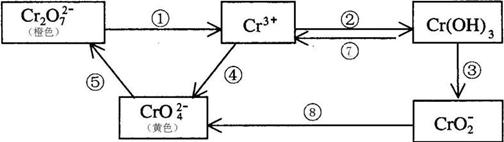 回答下列问题:
回答下列问题:
(1)铬原子的电子排布式
(2)上述反应中需用氧化剂的是 (填编号)。
(3)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,写出以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应和溶液中进行的反应的离子方程式 阳极 阴极
溶液中
(4)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
22.(14分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A ________ C ________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素在周期表的第_______周期________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)用电子式表示B的硫化物的形成过程:_________________________________
21.(10分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度: 。
|
滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
(6)根据上述各数据,计算烧碱的纯度; 。
20.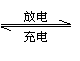 用铅蓄电池(总反应:Pb+PbO2+4H++2SO
用铅蓄电池(总反应:Pb+PbO2+4H++2SO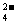 2PbSO4;
2PbSO4; +2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
下列说法中正确的是
A.铅蓄电池放电时的正极反应是:
PbO2+4H++SO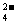 =PbSO4+2H2O
=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br一而不是Cl一,说明当其它条件相同时Br一的还原性强于Cl-
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 mol H2SO4
第Ⅱ卷(40分)
19.下列叙述不正确的是( )
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.一定温度下,IL 1mol/L的氨水与2L 0.5mol/L的氨水中,n(NH4+)前者多
C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸
D.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-)
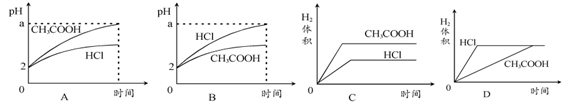
18.在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是
17、下面有关电化学的图示,完全正确的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com