
28.答案(17分)
(1)醛基
(2)加成反应
(3)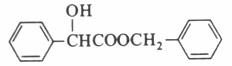
(4)
(5)13
(写出任意一种均给分)
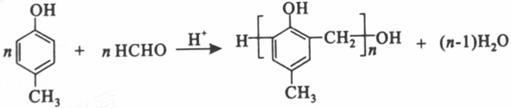
(6)
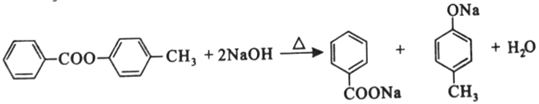
(7)

[解析]本题考查有机合成和推断。(1)根据A 扁桃酸的反应,结合提供的信息,可以推断A为
扁桃酸的反应,结合提供的信息,可以推断A为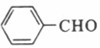 ,其含氧官能团的名称为醛基。(2)
,其含氧官能团的名称为醛基。(2) 与氢气的反应属于醛基的加成反应。(3)C为
与氢气的反应属于醛基的加成反应。(3)C为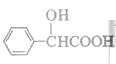 和
和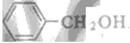 发生酯化反应的产物,其结构简式为
发生酯化反应的产物,其结构简式为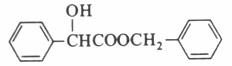 。(4)由醛的银镜反应可知,A发生银镜反应生成
。(4)由醛的银镜反应可知,A发生银镜反应生成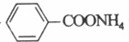 、Ag、NH3和H2O,化学方程式为:
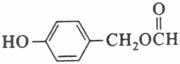
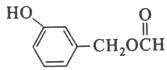
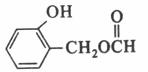
、Ag、NH3和H2O,化学方程式为:  。(5)扁桃酸的同分异构体属于甲酸酯且含有酚羟基,则苯环上有两种可能:①含有HCOOCH2-和-OH,二者在苯环上共用三种位置关系;②含有HCOO-、-OH、-CH3,三者在苯环上共用十种位置关系,因此其同分异构体总共有13种,其结构简式可以为
。(5)扁桃酸的同分异构体属于甲酸酯且含有酚羟基,则苯环上有两种可能:①含有HCOOCH2-和-OH,二者在苯环上共用三种位置关系;②含有HCOO-、-OH、-CH3,三者在苯环上共用十种位置关系,因此其同分异构体总共有13种,其结构简式可以为 等。(6)
等。(6)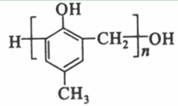 为甲醛和
为甲醛和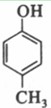 的缩聚反应。(7)根据转化关系,E为
的缩聚反应。(7)根据转化关系,E为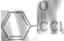 ,F为
,F为 ,二者发生取代反应生成
,二者发生取代反应生成 ,
, 与NaOH溶液发生水解反应:
与NaOH溶液发生水解反应: 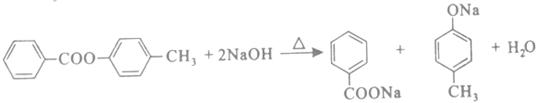 。
。

28.(17分)
镇痉药物C、化合物N以及高分子树脂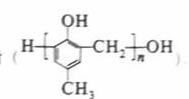 的合成路线如下:
的合成路线如下:
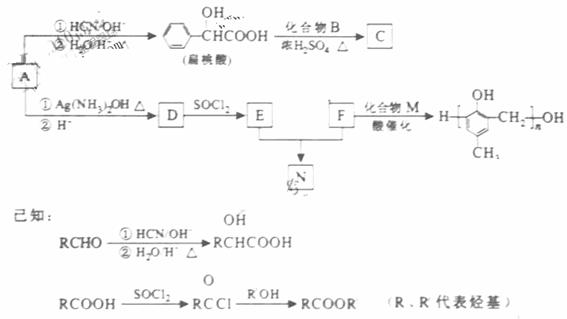
(1)A的含氧官能团的名称是 。
(2)A在催化剂作用下可与H2反应生成B。该反应的反应类型是 。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是 。
(4)A发生银镜反应的化学方程式是 。
(5)扁桃酸(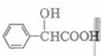 )有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有 种,写出其中一种含亚甲基(―CH2―)的同分异构体的结构简式 。
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有 种,写出其中一种含亚甲基(―CH2―)的同分异构体的结构简式 。
(6)F与M合成高分子树脂的化学方程式是 。
(7)N在NaOH溶液中发生水解反应的化学方程式是 。
27.答案(13分)
(1)
(2)淀粉KI试纸变蓝

 (3)
(3)

(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡。静至后 层溶液变为紫红色
层溶液变为紫红色
(5)确认C的黄色溶液中无 ,排除
,排除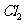 对溴置换碘实验的干扰。
对溴置换碘实验的干扰。
(6)原子半径逐渐增大
[解析]本题考查化学实验的设计和分析。(1)A中产生的黄绿色气体为Cl2,其电子式为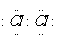 。(2)氯气遇淀粉KI试纸时,发生反应:Cl2+2KI=I2+2KCl,产生的I2遇淀粉变蓝,可以证明氯气的氧化性强于碘。(3)B中Cl2与NaBr发生置换反应,离子方程式为:Cl2+2Br-=2Cl-+Br2。(4)C中NaBr与氯气反应生成NaCl和Br2,将C中溶液滴入D中,发生反应:Br2+2KI=I2+2KBr,此时D中溶液分层,下层为碘的四氯化碳溶液,显紫红色,可以说明溴的氧化性强于碘。(5)过程Ⅲ主要为了确认C的黄色溶液中无Cl2,排出对溴置换碘实验的干扰。(6)Cl、Br、I单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱。
。(2)氯气遇淀粉KI试纸时,发生反应:Cl2+2KI=I2+2KCl,产生的I2遇淀粉变蓝,可以证明氯气的氧化性强于碘。(3)B中Cl2与NaBr发生置换反应,离子方程式为:Cl2+2Br-=2Cl-+Br2。(4)C中NaBr与氯气反应生成NaCl和Br2,将C中溶液滴入D中,发生反应:Br2+2KI=I2+2KBr,此时D中溶液分层,下层为碘的四氯化碳溶液,显紫红色,可以说明溴的氧化性强于碘。(5)过程Ⅲ主要为了确认C的黄色溶液中无Cl2,排出对溴置换碘实验的干扰。(6)Cl、Br、I单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱。
27.(13分)
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
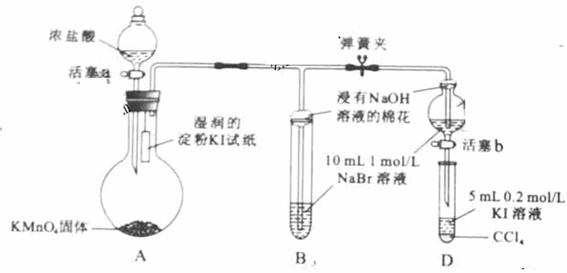
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减北的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
26.
 答案(1)①
答案(1)①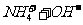
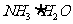
②废水中的NH3被空气带走, 的平衡向正反应方向移动,利于除氨
的平衡向正反应方向移动,利于除氨
(2)①放热
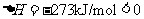 (反应物的总能量大于生成物的总能量)
(反应物的总能量大于生成物的总能量)

 ②
②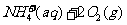
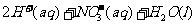
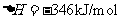
(3)5:6
[解析]本题考查化学工艺流程的分析。(1)①加NaOH溶液,氨氮废水中NH4+与OH-发生反应:NH4++OH-=NH3·H2O。②通空气将NH3带走,NH3·H2O NH3+H2O向正方向移动,利于除氨。(2)①第一步反应中反应物总能量大于生成物总能量,为放热反应。②根据盖斯定律,由第一步反应+第二步反应可得:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-273kJ/mol+-73kJ/mol=-346kJ/mol。(3)32gCH3OH的物质的量为
NH3+H2O向正方向移动,利于除氨。(2)①第一步反应中反应物总能量大于生成物总能量,为放热反应。②根据盖斯定律,由第一步反应+第二步反应可得:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-273kJ/mol+-73kJ/mol=-346kJ/mol。(3)32gCH3OH的物质的量为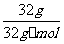 =1mol,转移6mol电子时,根据HNO3
=1mol,转移6mol电子时,根据HNO3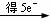
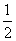 N2,由得失电子守恒,则参加反应的HNO3的物质的量为1.2mol,故氧化剂与还原剂的物质的量之比为:1.2:1=6:5。
N2,由得失电子守恒,则参加反应的HNO3的物质的量为1.2mol,故氧化剂与还原剂的物质的量之比为:1.2:1=6:5。
26.(14)
某氮肥厂氨氮废水中的氮元素多以NH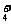 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
(2)过程Ⅱ:在微生物作用的条件下,NH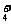 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
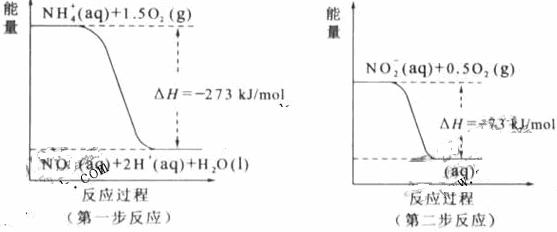
①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 。
②1 mol NH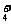 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是 。
(aq)的热化学方程式是 。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
25.答案(14分)
(1)CO2
(2) 钠 硅

 (3)
(3)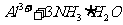
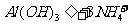

 (4)
(4)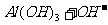

(5)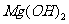
(6)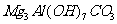
[解析]本题考查抗酸药成分的探究实验。(1)Ⅰ中气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,该气体为CO2。(2)根据Ⅰ,一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,根据Ⅱ,一定不含Na,因为Na的焰色为黄色。(3)根据提供资料,Ⅲ中调解pH至5-6时生成的白色沉淀为Al(OH)3。(4)Ⅳ中加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-=AlO2-+H2O。(5)Ⅴ中加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2。(5)根据上述实验探究,该抗酸药为Al(OH)3、MgCO3、碱式碳酸镁铝组成,由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3。
[知识归纳]常见的抗酸药的类型及其抗酸原理为:
|
种类 |
化学方程式 |
离子方程式 |
|
NaHCO3 |
NaHCO3+HCl=NaCl+H2O+CO2↑ |
HCO3-+H+=H2O+CO2↑ |
|
CaCO3 |
CaCO3+2HCl=CaCl2+H2O+CO2↑ |
CaCO3+2H+=Ca2++H2O+CO2↑ |
|
MgCO3 |
MgCO3+2HCl=MgCl2+H2O+CO2↑ |
MgCO3+2H+=Mg2++H2O+CO2↑ |
|
Mg(OH)2 |
Mg(OH)2+2HCl=MgCl2+2H2O |
Mg(OH)2+2H+=Mg2++2H2O |
|
Al(OH)3 |
Al(OH)3+3HCl=AlCl3+3H2O |
Al(OH)3+3H+=Al3++3H2O |
25.(14分)
由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;
Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
I.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5-6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ. 向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
(1)I中气全A可使澄清石灰水变浑浊,A的化学式是 。
(2)由I、Ⅱ判断X一定不含有的元素是磷、 。
(3)Ⅲ中生成B的离子方程式是 。
(4)Ⅳ中B溶解的离子方程式是 。
(5)沉淀C的化学式是 。
(6)若上述n(A):n(B):n(C)=1:1:3,则X的化学式是 。
12.答案C
[解析]本题考查化学平衡常数及转化率的计算。设平衡时甲中CO2的转化浓度为x,则平衡时H2、CO2、H2O、CO的浓度分别为0.01-x、0.01-x、x、x,根据平衡常数K=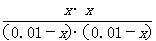 =
=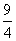 ,解得x=0.006,则甲中CO2的转化率为
,解得x=0.006,则甲中CO2的转化率为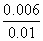 ×100%=60%,由于乙相对甲,增加了c(H2),因此CO2的转化率增大,A项正确;设平衡时丙中CO2的转化浓度为y,则平衡时H2、CO2、H2O、CO的浓度分别为0.02-y、0.02-y、y、y,根据平衡常数K=
×100%=60%,由于乙相对甲,增加了c(H2),因此CO2的转化率增大,A项正确;设平衡时丙中CO2的转化浓度为y,则平衡时H2、CO2、H2O、CO的浓度分别为0.02-y、0.02-y、y、y,根据平衡常数K=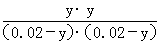 =
=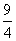 ,解得x=0.012,则丙中CO2的转化率为
,解得x=0.012,则丙中CO2的转化率为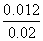 ×100%=60%,B项正确;平衡时甲中c(CO2)=0.01-0.006=0.004mol/L,丙中c(CO2)=0.02-0.012=0.008mol/L,C项错误;反应开始时,丙中反应物浓度最大,反应速率最快,甲中反应物浓度最小,反应速率最慢,D项正确。
×100%=60%,B项正确;平衡时甲中c(CO2)=0.01-0.006=0.004mol/L,丙中c(CO2)=0.02-0.012=0.008mol/L,C项错误;反应开始时,丙中反应物浓度最大,反应速率最快,甲中反应物浓度最小,反应速率最慢,D项正确。
第Ⅱ卷(非选择题,共180分)
本卷共11小题,共180分。
12.某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=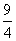 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。
|
起始浓度 |
甲 |
乙 |
丙 |
|
c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
|
c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com