
2.已知全集为U=R,集合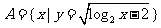 ,
,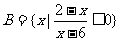 ,则
,则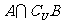 =( )
=( )
A.{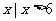 } B.
} B.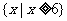 C.
C.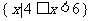 D.
D.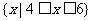
1.复数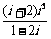 等于( )
等于( )
A.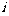 B.
B.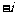 C.
C.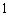 D.
D.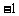
30.(1)(3分)某校研究性学习小组欲配制1000g溶质质量分数为15%的氢氧化钠溶液。需氢氧化钠固体_______g,水 mL(水的密度是1g/cm3);称量氢氧化钠时 (填“能”或“不能”) 放在纸上称量。
(2)(6分)甲乙丙丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关。
[理论分析]
①甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是
。
②乙同学的猜想也不正确,理由是 。
[实验设计]
③为证实丙同学的猜想,还需作如下实验,请完成下表。
|
实验步骤 |
设计这一步骤的目的 |
|
1.用煮沸过的蒸馏水配制氢氧化钠溶液。 |
|
|
2.在氢氧化钠溶液中滴入酚酞,并在上 方滴一些植物油。 |
|
④通过以上实验,四位同学看到:溶液先变成红色,一会儿红色又消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,设计如下实验证明并完成有关问题:
|
实验方法 |
观察到的现象和结论 |
|
方案一:分别配制不同质量分数的氢氧化钠溶液,然后各滴加2滴酚酞试液。 |
质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明 。 |
|
方案二:将滴有酚酞试液的质量分数大的氢氧化钠溶液加水稀释 |
。 |
(3)(8分)该校研究性学习小组向上述所配制的15%的氢氧化钠溶液中滴加稀盐酸,有气泡产生,由此可知所用的NaOH固体已变质。写出氢氧化钠在空气中变质的化学方程式 ;所以氢氧化钠应该 保存。(2分)
[提出问题]所用的NaOH变质程度怎样?
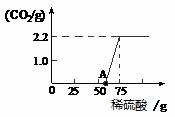 [设计方案]先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数。
[设计方案]先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数。
[进行实验]实验测得加入稀硫酸的质量与产生CO2
气体的质量关系如下图所示。
[数据处理]写出以下计算过程:
该样品中NaOH的质量分数为多少?(4分)
[反思与交流]①从图中0-A点说明:在NaOH 与Na2CO3的混合溶液中,加入稀硫酸,首先反应的物质是 ;②根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗稀硫酸的量 (填“相等”或“大于”或“小于”。(2分)
29. (5分)学习化学要求熟悉物质的性质以及物质之间的相互转化。以下框图中的物质均为初中化学中的常见物质,其中甲、乙、丙、丁、戊均为单质,常温下,丁为黑色固体,戊为紫红色金属。农业上常用F改良酸性土壤。常温下,G是一种具有刺激性气味的气体,其水溶液显碱性,工业上用甲和丙化合制备G。
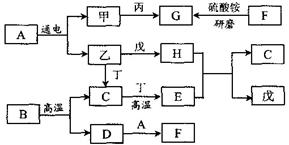
(1)写出A、F和G的化学式:A F G
(2)写出高温条件下B分解为C和D的化学方程式:
(3)写出H和E在加热条件下生成C和戊的化学方程式:
28.(5分)有一包粉末可能含有碳酸钙、碳酸钠、硫酸钠、硫酸铜、硝酸钠中的一种或几种,某学生为了确定其组成,做如下实验,请根据实验现象进行推断,把相应的物质的化学式填在表中的空格内。
|
实验内容和步骤 |
实验现象 |
结论 |
|
(1)在试管中加入少量粉末,注入足量的蒸馏水充分振荡 |
溶液无色透明,没有沉淀物 |
原粉末中肯定不含的物质是 , 。 |
|
(2)取少量上述溶液滴入盐酸 |
有气泡产生 |
肯定有的物质是
。 |
|
(3)另取(1)中少量溶液滴入氯化钡溶液 |
有白色沉淀产生 |
原粉末中肯定还有的物质是
。 可能有的物质是 。 |
|
(4)在(3)中滴加稀硝酸 |
沉淀部分溶解,并有气泡产生 |
27.(7分)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并探究氨气性质。查阅资料得到氨气的一些性质:无色、有刺激性气味的气体,比空气轻;易液化得液氨;极易溶于水。
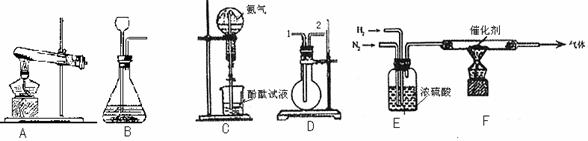 (1)将熟石灰与氯化铵混合加热可以用于制备氨气,请从上图中选择装置 用于制备该气体,试管中的化学反应是(填写化学方程式)
,若采用装置D来收集氨气,气体应从 端进入。
(1)将熟石灰与氯化铵混合加热可以用于制备氨气,请从上图中选择装置 用于制备该气体,试管中的化学反应是(填写化学方程式)
,若采用装置D来收集氨气,气体应从 端进入。
(2)装置C 能够形成红色的喷泉,这说明了氨气具有 、 的性质。
(3)实验室模拟合成氨的实验中,先将氮气和氢气通过E装置,E装置的作用除了使氢气和氮气气流稳定以及使气体充分混合外,还有 的作用;装置F用于合成氨,铂丝作为催化剂可反复使用,这是因为 。
26.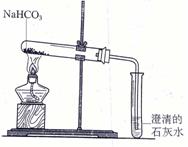 (4分)如图所示,加热碳酸氢钠可以观察到澄清石灰水变浑浊,试管壁上有水珠,同时试管内留下一种白色的盐类物质,
(4分)如图所示,加热碳酸氢钠可以观察到澄清石灰水变浑浊,试管壁上有水珠,同时试管内留下一种白色的盐类物质,
(1)通过该实验可知热稳定性强弱
为NaHCO3热稳定性 (填“大于”或“小于”)Na2CO3热稳定性;
(2)NaHCO3受热分解的化学方程式为 ;
(3)澄清的石灰水若变浑浊,浑浊的原因是:(用化学方程式表示) ;
(4)实验结束时,为防止倒吸,应进行的操作是 。
25.(5分)消毒剂在公共场所进行卫生防疫时发挥着重要的作用。
(1)二氧化氯可用于饮用水的杀菌消毒,该物质的化学式为 ,其中氯元素的化合价为________。
(2)氧化钙与水反应后生成一种具有消毒能力的物质,该反应的化学方程式为
;该反应 (填放热或吸热)。
(3)奥运会游泳、跳水等运动项目在“水立方”举行,比赛池中的水要定期进行消毒处理。按照物质的分类,下列某种消毒剂与其他三种消毒剂不属于同一类的是 (填序号)。
A.Cl2 B.KMnO4 C.Ca(OH)2 D.CuSO4
24.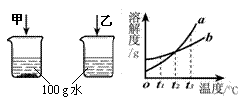 (4分)结合图1和图2回答问题:在t1℃
(4分)结合图1和图2回答问题:在t1℃
时,等质量的甲、乙两种固体物质在水中的溶
解现象如图1所示,
|
的方法有 (写出一种即可)。
(2)图2中a、b分别表示上述两种物质的溶解度曲线,a表示的是 (填“甲”或“乙”)的溶解度曲线。在 ℃时,两种物质的溶解度相等;
(3)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是 。
23.(5分)在2008年3月24日的北京奥运会圣火采集现场,最高女祭司手中取火用的火炬中,用来充当引火之物的引子是折叠好的电影胶片。而在早期取火仪式中,火炬中填充的是干草。如今之所以偏爱胶片,是因为胶片是以硝酸纤维素为主要成分,比干草更易燃。最高女祭司采集圣火成功之后,首先用手中的火炬引燃了一旁的火种罐,火种罐中盛放的是希腊当地的特产橄榄油。
试回答下列问题:
(1)根据燃烧的条件,胶片是 ;
(2)干草的着火点 (填“高于”或“低于”或“等于”)胶片的着火点;
(3)硝酸纤维素的化学式为C6H7O2(ONO2)3,下列有关硝酸纤维素的说法中错误的是( )
A.其中碳、氢、氧、氮元素的质量比为6:7:11:3
B.它的相对分子质量为297
C.它是一种有机物
D.它是由碳、氢、氧、氮四种元素组成
(4)橄榄油中含有多种物质,油酸(单不饱和脂肪酸):70-80%,亚油酸(多不饱和脂肪酸):6-9%,棕榈酸(饱和脂肪酸):7-15%,另外还含有维生素A和E。油酸的化学式为C18H3402。
①橄榄油是 (选填“纯净物”、“混合物”)。
②油酸完全燃烧的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com