
2.
设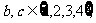 则方程
则方程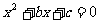 有实数根的概率是 ______________.
有实数根的概率是 ______________.
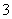 .若连续投掷两枚骰子分别得到的点数
.若连续投掷两枚骰子分别得到的点数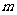 、
、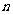 作为点
作为点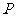 的坐标
的坐标 ,求点
,求点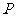 落在圆
落在圆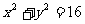 内的概率为
.
内的概率为
.
4 将一骰子连续抛掷三次,它落地时向上的点数依次成等差数列的概率为__________
[典型例析]
例1:设有关于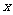 的一元二次方程
的一元二次方程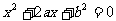 .若
.若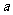 是从
是从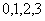 四个数中任取的一个数,
四个数中任取的一个数,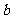 是从
是从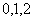 三个数中任取的一个数,求上述方程有实根的概率.
三个数中任取的一个数,求上述方程有实根的概率.
例2甲、乙二人用4张扑克牌(分别是红桃2,红桃3,红桃4,方片4)玩游戏,他们将扑克牌洗匀后,背面朝上放在桌面上,甲先抽,乙后抽,抽出的牌不放回,各抽一张。
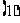 设
设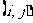 分别表示甲、乙抽到的牌的数字,写出甲乙二人抽到的牌的所有情况;
分别表示甲、乙抽到的牌的数字,写出甲乙二人抽到的牌的所有情况;
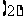 若甲抽到红桃
若甲抽到红桃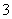 ,则乙抽出的牌面数字比
,则乙抽出的牌面数字比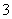 大的概率是多少?
大的概率是多少?
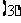 甲乙约定:若甲抽到的牌的牌面数字比乙大,则甲胜,否则,则乙胜。你认为此游戏是否公平,说明你的理由。
甲乙约定:若甲抽到的牌的牌面数字比乙大,则甲胜,否则,则乙胜。你认为此游戏是否公平,说明你的理由。
例3把一颗均匀的骰子投掷两次,记第一次出现的点数为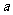 ,第一次出现的点数为
,第一次出现的点数为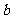 ,试就方程组
,试就方程组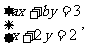 解答下列问题:
解答下列问题:
 求方程组只有一解的概率;
求方程组只有一解的概率;
 求方程组只有正数解的概率
求方程组只有正数解的概率 .
.
[基础自测]
 从
从 中任取3个,组成没有重复数字的三位数,则三位数是5的倍数的概率为__________.
中任取3个,组成没有重复数字的三位数,则三位数是5的倍数的概率为__________.
 若将一颗质地均匀的骰子先后投掷两次,则出现向上的点数之和为
若将一颗质地均匀的骰子先后投掷两次,则出现向上的点数之和为 的概率是 .
的概率是 .
 在平面直角坐标系中,从五个点:
在平面直角坐标系中,从五个点: ,
, ,
, 中任取三个,这三点能构成三角形的概率是_____________.
中任取三个,这三点能构成三角形的概率是_____________.
 在某地的奥运火炬传递活动中,有编号为
在某地的奥运火炬传递活动中,有编号为 的
的 名火炬手.若从中任选
名火炬手.若从中任选 人,则选出的火炬手的编号能组成以
人,则选出的火炬手的编号能组成以 为公差的等差数列的概率为____________.
为公差的等差数列的概率为____________.
1.
在所有的两位数中,任取一个数,则这个数能被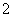 或
或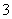 整除的概率为 .
整除的概率为 .
5.B 根据题给信息可知:原电池的负极应为葡萄糖,正极应为O2。由于细胞液呈弱碱性,所以负极反应为:C6H12O6+24OH――24e-=6CO2+18H2O,生成的CO2与OH-作用生成CO32-、HCO3-。正极反应为:O2+2H2O+4e-=4OH-。所以答案为B。
4.B 原反应为:Cl2+H2O H++Cl-+HClO,再通入少量氯气后,c(H+)与c(HClO)同等程度增大,若HClO的电离程度不变,c(H+)/c(ClO-)应该相等,但实际上HClO的电离程度减小,使c(ClO-)增大倍数不够,所以c(H+)/c(ClO-)增大,SO2与Cl2反应而使溶液漂白性减弱,B错。据电荷守恒有:
H++Cl-+HClO,再通入少量氯气后,c(H+)与c(HClO)同等程度增大,若HClO的电离程度不变,c(H+)/c(ClO-)应该相等,但实际上HClO的电离程度减小,使c(ClO-)增大倍数不够,所以c(H+)/c(ClO-)增大,SO2与Cl2反应而使溶液漂白性减弱,B错。据电荷守恒有:
c(Na+)+c(H+) = c(Cl-)+c(ClO-)+c(OH-),当溶液呈中性时,c(H+) = c(OH-),才有c(Na+)=c(Cl-)+
c(ClO-),C错。D中加入少量的水,相当于增大了水的量,c(H+)下降,对水的电离的抑制作用减弱,水的电离平衡向正反应方向移动。D正确。
3.B 化学平衡状态的标志是反应混合物中各组分的百分含量保持不变的状态。也就是各物质的含量为定值,A正确;B中如为增大压强,则正、逆反应速率同时增大,与原平衡没有连结点,所以B不符合示意图;C选项中增大反应物浓度,平衡正向移动,正反应速率突然增大,而逆反应速率从原平衡逐渐增大,符合题意;D选项中,同一种反应物在平衡态I和平衡态II时,由于平衡发生了移动,所以浓度不可能相等。
电化学理论包括原电池理论和电解理论。原电池理论的主要内容:判断某装置是否是原电池并判断原电池的正负极、书写电极反应式及总反应式;原电池工作时电解质溶液及两极区溶液的pH的变化以及电池工作时溶液中离子的运动方向;新型化学电源的工作原 理。特别注意的是高考关注的日常生活、新技术内容有很多与原电池相关,还要注意这部分内容的命题往往与化学实验、元素与化合物知识、氧化还原知识伴随在一起。同时原电池与生物、物理知识相互渗透如生物电、废旧电池的危害、化学能与电能的转化、电池效率等都是理综命题的热点之一。电解原理包括判断电解池、电解池的阴阳极及两极工作时的电极反应式;判断电解池工作中和工作后溶液和两极区溶液的pH变化;电解原理的应用及电解的有关计算。命题特点与化学其它内容(如实验、电解质理论、环境保护)综合,电解原理与物
理。特别注意的是高考关注的日常生活、新技术内容有很多与原电池相关,还要注意这部分内容的命题往往与化学实验、元素与化合物知识、氧化还原知识伴随在一起。同时原电池与生物、物理知识相互渗透如生物电、废旧电池的危害、化学能与电能的转化、电池效率等都是理综命题的热点之一。电解原理包括判断电解池、电解池的阴阳极及两极工作时的电极反应式;判断电解池工作中和工作后溶液和两极区溶液的pH变化;电解原理的应用及电解的有关计算。命题特点与化学其它内容(如实验、电解质理论、环境保护)综合,电解原理与物 理知识联系紧密,学科间综合问题。
理知识联系紧密,学科间综合问题。
考点一“位--构--性”三者关系
[例1]X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径由小到大的顺序为:W<X<Z< Y
C.X与W可以形成W2X、W2X2两种氧化物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物稳定
 变式1 X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是
变式1 X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是
A.原子半径的大小顺序:Z > Y >X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物对应的水化物不能互相反应
考点二 氧化还原反应规律应用
[例2]水热法制备Fe3O4纳米颗粒的反应是
3Fe2++2S2O32-+O2+xOH- Fe3O4+S4O62-+2H2O,下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为2mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
[解析]B;本题根据电荷守恒可确定x的值,3×2-4-x =-2,x=4,Fe3O4中两个铁为+3价,一个铁为+2价,在反应中每生成1molFe3O4同时消耗1mol
O2,所以转移的电子数为4 mol,S2O32-中S由+2价升高为+5/2价,所以还原剂有Fe2+、S2O32-,而氧化剂为O2。1mol
Fe2+被氧化时,提供1 mol电子,被Fe2+还原的O2的物质的量为1/4mol。
=-2,x=4,Fe3O4中两个铁为+3价,一个铁为+2价,在反应中每生成1molFe3O4同时消耗1mol
O2,所以转移的电子数为4 mol,S2O32-中S由+2价升高为+5/2价,所以还原剂有Fe2+、S2O32-,而氧化剂为O2。1mol
Fe2+被氧化时,提供1 mol电子,被Fe2+还原的O2的物质的量为1/4mol。
变式2 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3- +4H++3e- = NO+2H2O
K MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________________。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
考点三 化学反应速率、化学平衡
 [例3]在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是
[例3]在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol·L-1·min-1
C.4min后,向容 器中充入不参与反应的稀有气体,M的物质的量减小
器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L-1
[解析]答案为A。反应开始时,M的浓 度为2÷2=1mol/L,平衡时为0.2mol·L-1,转化了0.8mol·L-1,M转化率为
度为2÷2=1mol/L,平衡时为0.2mol·L-1,转化了0.8mol·L-1,M转化率为 80%。4min时,用M表示的反应速率为0.8mol·L-1÷4=0.2mol·L-1·min-1,恒温恒容下,充入不反应的稀有气体,各组分的浓度没有发生变化,所以正逆反应速率不变,平衡不移动,M的物质的量不变;反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol·L-1,所以2min时,M的物质的量浓度应小于0.6mol·L-1。
80%。4min时,用M表示的反应速率为0.8mol·L-1÷4=0.2mol·L-1·min-1,恒温恒容下,充入不反应的稀有气体,各组分的浓度没有发生变化,所以正逆反应速率不变,平衡不移动,M的物质的量不变;反应从开始到平衡的过程中,正反应速率越来越小,当进行2min时,M浓度的变化值大于0.4mol·L-1,所以2min时,M的物质的量浓度应小于0.6mol·L-1。
变式3如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
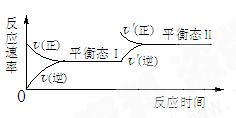
A.反应达平衡时,各物质的含量为定值
B.该反应达到平衡态I后,增大压强,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度一定不相等
考点四 电解质理论
[例4]下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH- = SO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
C.盐酸滴入氨水中:H++OH- = H2O
D.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ = 2Fe3++2H2O
[解析]离子反应方程式的正误判断和书写是高考的热点题型,本题中A选项SO2过量,生成产物应为HSO3-而不是SO32 -,正确的应为SO2+OH- = HSO3-;B选项酸性环境中,NO3-具有强氧化性,其氧化性大于Fe3+,能氧化I-成I2,正确的为2NO3-+6I-+8H+=2NO+3I2+4H2O。C选项中氨水为弱碱,在离子方程式中不能拆开写,正确写法为H++NH3·H2O=NH4+ + H2O;D选项中双氧水具有氧化性,在酸性条件下能把Fe2+氧化为Fe3+,同时生成水,注意离子反应式两边的电荷守恒和得失电子守恒。
变式4氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述不正确的是
A.再通入 少量氯气,c(H+)/c(C
少量氯气,c(H+)/c(C lO-)增大
lO-)增大
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
考点五 电化学理论
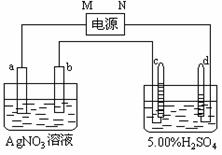 [例5]图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
[例5]图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 __g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成
的物质的物质的量之比为:2∶___∶_ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,
AgNO3溶液的pH ,H2SO4溶液的浓度 ,
H2SO4溶液的pH ___。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
5. 00%x=5.02%(x-0.18),解得:x=45.18g。
00%x=5.02%(x-0.18),解得:x=45.18g。
变式5生物体中细胞膜内的葡萄糖(C6H12O6 ) 与细胞膜外的碱性富氧液体及细胞膜构成微型的生物原电池。下列有关电极反应及其产物的判断正确的是
与细胞膜外的碱性富氧液体及细胞膜构成微型的生物原电池。下列有关电极反应及其产物的判断正确的是
A.负极反应可能是O2+2H2O+4e-=4OH-
B.负极反应的产物主要是C6H12O6被氧化生成的CO32-、HCO3-、H2O
C.正极反应可能是C6H12O6+24OH――24e-=6CO2+18H2O
D.正极反应的产物主要是葡萄糖生成的CO2、HCO3-、H2O
 (4)使用了较浓的硝酸,产物中有部分二氧化氮生成。
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成。
3.酸碱中和滴定及相关计算。
2.盐类的水解及其应用,特别是离子浓度大小比较、离子共存问题。
电解质理论重点考查弱电解质电离平 衡的建立,电离方程式的书写,外界条件对电离平衡的影响,酸碱中和反应中有关弱电解质参与的计算和酸碱中和滴定实验原理,水的离子积常数及溶液中水电离的氢离子浓度的有关计算和pH的计算,溶液酸碱性的判断,不同电解质溶液中水的电离程度大小的比较,盐类的水解原理及应用,离子共存、离子浓度大小比较,电解质理论与生物学科之间的渗透等。重要知识点有:
衡的建立,电离方程式的书写,外界条件对电离平衡的影响,酸碱中和反应中有关弱电解质参与的计算和酸碱中和滴定实验原理,水的离子积常数及溶液中水电离的氢离子浓度的有关计算和pH的计算,溶液酸碱性的判断,不同电解质溶液中水的电离程度大小的比较,盐类的水解原理及应用,离子共存、离子浓度大小比较,电解质理论与生物学科之间的渗透等。重要知识点有:
1.弱电解质的电离平衡及影响因素,水的电离和溶液的pH及计算。
4.用反应速率和化学平衡理论解释在日常实际生活、工农业生产中遇到的化学问题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com