
25.将5.13g Ba(OH)2粉末加入100 ml硫酸和盐酸的混合液中,充分反应至沉淀不再生成时,过滤得干燥沉淀5.825g。取滤液20ml跟足量铁粉反应,生成22.4ml(标准状况下)气体。求:
⑴滤液的pH
⑵原混合液中c(Clˉ)、c(SO42ˉ)。
农七师高级中学2009-2010学年(下)
24.Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.7g食盐 B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液
D.用200ml容量瓶配制500ml 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:

c (NaOH) = _______________________________________。
(3)下列操作会引起测定的NaOH物质的量浓度偏大的是______________
A.若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定到终点时,仰视读数
D.滴定时,反应容器振荡太激烈,有少量液体溅出
23.(3分)实验室配置硫酸铝溶液时常滴入少量稀硫酸
22.(3分)在滴有酚酞的氨水中加入NH4Cl溶液后红色变浅
21.(8分)判断原电池的正负极时,不仅要看金属活泼性顺序,还要注意此金属在电解质溶液中的活泼性。试回答下列问题:
(1)用铝、铜和稀硫酸组成的原电池中, 是负极, 是正极;原因是 。
(2)用铝、铜和浓硝酸组成的原电池中, 是负极, 是正极;原因是 。
(3)将铝片和铜片用导线连接,一组插入浓硝酸中,一组插入氢氧化钠溶液中,分别形成了原电池,则在这两个原电池中,负极分别是( )
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
20.(6分)今含有a:CH3COOH 、b:HCl、 c:H2SO4三种溶液。
(1)当它们的pH相同时,其物质的量浓度的关系是_____________________
(2)当它们的的物质的量浓度相同时,其pH关系是_____________________
(3)中和同一烧碱溶液,需同浓度的三种溶液的体积关系是_______________
(4)体积、浓度相同的a、b、c三溶液,分别与同浓度的NaOH溶液反应使pH等于7,所需NaOH溶液的体积关系是_______________
(5)某温度下,纯水中的c(H+)=2.0x10-7mol/L,则此时溶液中的c(OH-)为__________mol/L
若温度不变,滴入稀盐酸使c(H+)=5.0x10-6mol/L,则c(OH-)为____________mol/L
19.(8分)写出下列物质电离或盐水解的离子方程式:
(1)NaHSO4溶于水_______________________________________________________
(2) H2S的电离________________________________________________________
(3)氯化铁溶液: ;
(4)碳酸钠溶液: ;
(5)AlCl3与NaHCO3混合____________________________________________________
18.下列叙述正确的是( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)+c(CH3COO-)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
17.(平行班做)常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是( )
A.c(CH3COO-)>c(Na+)>c(OH-)>c(H+) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
17.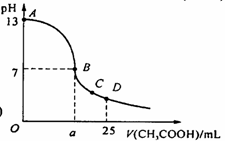 (实验班做)在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )
(实验班做)在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )
A.在A、B间任一点,溶液中一定都有
c(Na+) > c(CH3COO-) > c(OH-) > c(H+)
B.在B点,a > 12.5,且有
c(Na+) = c(CH3COO-) = c(OH-) = c(H+)
C.在C点:c(CH3COO-) = c(Na+) > c(H+) > c(OH-)
D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com