
②
50mL水
23.(共9分)⑴高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有
①试管中(填产生沉淀或气体及反应速率等相关现象) ▲ 。
②两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(酸均足量) ▲ 。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义): HCO3-(aq)+ H+(aq) =H2O(l)+ CO2(g) ;△H>0
CO32-(aq)+ 2H+(aq)= H2O(l) + CO2(g) ;△H<0
甲下结论的方法是否正确 ▲ (填“正确”或“不正确”)
⑵ 为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号
试剂1
试剂2
混合前温度
混合后最高或最低温度
①
50mL水

试填写下列空白:
(1)甲元素的单质在空气中燃烧时除得到A外,还可得到 ▲ ,所得固体中加入足量盐酸充分反应后,取部分溶液蒸干灼烧后所得固体为 ▲ 。
(2)B呈固态时的密度比液态时的密度 ▲ (填“大”或“小”),主要的原因是 ▲ 。
(3)“E + D→G + B”的化学方程式为: ▲ 。
“E + CuO”的化学方程式为: ▲ 。
22.(共7分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为
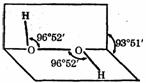
21.(共7分)过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与
O-O键之间的空间夹角约为97°
(1)H2O2的电子式为 ▲ ,其分子属于 ▲ (填:“极性”或“非极性”)分子。
(2)经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式
▲ 双氧水中加入过量的Ba(OH)2溶液,其反应的离子方程式是 ▲ 。
(3)H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 ▲ ,并标出电子转移的方向与数目 ▲ 。
(4)为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3?3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选) ▲ 。
A . MnO2 B. H2S C. 稀H2SO4 D NaHCO3
 卷Ⅱ(非选择题,共45分)
卷Ⅱ(非选择题,共45分)
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度为
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
20. 某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g)+ xG(g);△H<0。若起始时E的浓度为amol/L,F、G的浓度均为0,达到平衡时E的浓度为0.5amol/L;若E的起始浓度改为2amol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+ xG(g);△H<0。若起始时E的浓度为amol/L,F、G的浓度均为0,达到平衡时E的浓度为0.5amol/L;若E的起始浓度改为2amol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
A.升高温度时,正反应速率加快,逆反应速率减慢
B.若x=1,容器体积保持不变,新平衡下E的体积分数为50%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com