
37.[化学-选修3物质结构与性质](15分)
下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|||||||||||||||
|
② |
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
⑦ |
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
请回答下列问题:
(1)元素③④⑤的第一电离能由小到大的顺序为 。(填元素符号)
(2)元素⑧基态原子核外电子排布式为
(3)②、③、④、⑤、⑥的氢化物的沸点(℃)直角坐标图(如下图),序列“1”的氢化物形成 晶体;序列“2”的氢化物,其中心原子的杂化轨道类型是 杂化;序列“5”的氢化物的空间构型为 。序列“3”的氢化物和序列“4”的氢化物反应生成产物的电子式为 。
(4)元素⑦形成的单质晶体是下图中的 ,配位数为 。元素⑦、⑧形成单质晶体哪一种空间利用率高? (填元素符号)。
36.[化学-选修2化学与技术] (15分)
聚合氯化铝晶体珠化学式为[Al2(OH)nCl6-n·XH2O]m它是一种高效无机水处理剂,它的制备原理是通过增大AlCl3溶液的pH,促进其水解而结晶析出。制备聚合氯化铝晶体的原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al还有SiO2等杂质。聚合氯化铝生产工艺流程如下:
(1)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)
(2)反应中副产品a是 。
(3)生产过程中可循环使用的物质是 (用化学式表示)
(4)调节pH至4.0~4.5的目的是 。
(5)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质最好选用 。
①NaOH ②NaHCO3 ③氨水 ④Al2O3
35.[物理3-5模块](15分)
Ⅰ、氢原子的核外电子从距核较近的轨道跃迁到距核较远的轨道过程中 ( )
A.原子要吸收光子,电子的动能增大,原子的电势能增大
B.原子要放出光子,电子的动能减小,原子的电势能减小
C.原子要吸收光子,电子的动能增大,原子的电势能减小
D.原子要吸收光子,电子的动能减小,原子的电势能增大
Ⅱ、在光滑的水平面上,甲、乙两物质的质量分别为m1、m2,它们分别沿东西方向的一直线相向运动,其中甲物体以速度6m/s由西向东运动,乙物体以速度2m/s由东向西运动,碰撞后两物体都沿各自原方向的反方向运动,速度的大小都是4m/s求:
①甲、乙两物体质量之比;
②通过计算说明这次碰撞是弹性碰撞还是非弹性碰撞。
34.[物理3-4模块](15分)
Ⅰ、用绿光做双缝干涉实验,在光屏上呈现出明、暗相间的绿条纹,相邻两条绿条纹间的距离为Δx.下列说法中正确的有 ( )
A.如果增大单缝到双缝间的距离,Δx将增大
B.如果增大双缝之间的距离,Δx将增大
C.如果增大双缝到光屏之间的距离,Δx将增大
D.如果减小双缝的每条缝的宽度,而不改变双缝间的距离,Δx将增大
Ⅱ、如图所示,实线和虚线分别是沿x轴传播的一列简谐横波在t=0和t=0.06s时刻的波形图。已知在t=0时刻,x=1.5m处的质点向y轴正方向运动。
(1)判断该波的传播方向;
(2)求该波的最小频率;
(3)若3T<t<4T,求该波的波速。
33.[物理3-3模块](15分)
Ⅰ、在地球上,将一滴较大的水银放在水平放置的玻璃板上,水银滴呈扁平形状.如果将此装置放在绕地球做匀速圆周运动的宇宙飞船上,水银滴将呈 状,这是因为液体的表面存在 的作用.
Ⅱ、如图所示,质量为m=10 kg的活塞将一定质量的理想气体密封在气缸中,开始时活塞距气缸底高度h1= 40 cm.此时气体的温度T1=300 K.现缓慢给气体加热,气体吸收的热量Q=420 J,活塞上升到距气缸底h2=60 cm.已知活塞面积S=50 cm2,大气压强p0=1.0×105 Pa,不计活塞与气缸之间的摩擦,g取10 m/s2,求:
(1)当活塞上升到距气缸底h2时,气体的温度T2.
(2)给气体加热的过程中,气体增加的内能ΔU.
32.(10分)下列是某生物兴趣小组的一个问题探究实例:
(1)图-3中A的主要成分是水还是油?
(2)请根据探究-1和探究-2的结果推导细胞膜上磷脂分子的排布情况,在图-4中绘出其简图(片段)。
(3)根据图-4所示结果,科学家利用纯磷脂制成“脂质体”,作为细胞模型。将“脂质体”
放置于清水中,一段时间后发现,“脂质体”的形态、体积都没有变化。
①这一事实表明: 。进一步根据细胞膜的化学成分分析推测,水分子的跨膜运输不是真正的自由扩散,它最可能与膜上的蛋白质有关。
②彼德·阿格雷从人红细胞及肾小管细胞的膜中分离出一种分子量为28道尔顿的膜蛋白--CHIP28,并证明它是一种“水通道蛋白”。请简述证明CHIP28确实与水分子运输有关的实验基本思路。 。
③有实验证明钾离子也不能通过该“脂质体”,若要使钾离子通过,则该“脂质体”模型中还需要具备哪些物质?
31.(12分)已知番茄的红果( R )对黄果( r )为显性,高茎( H )对矮茎( h )为显性。甲图为某红果高茎番茄与黄果矮茎番茄测交得到子一代,再与黄果矮茎番茄测交得到子二代的结果据图分析回答:
(l)该红果高茎番茄植株的基因型是 ,如果该植株自花传粉,收获果实的颜色是 ,果皮颜色的遗传是 (细胞核遗传、细胞质遗传)。果皮颜色的遗传遵循 定律。
(2)乙图为用该红果高茎番茄的花粉进行实验的示意图,植株 A 称为 ,基因型种类及比例是 。秋水仙素作用的原理是 。
30.(10分)在生命奥秘的探索过程中,染色体作为遗传物质的主要载体,人们对它的研
究和应用日益深入。2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染
色体的三位学者。端粒(右图中染色体两端所示)通常是由富含鸟嘌呤核苷酸(G)的短的串联重复序列组成。它们能防止不同染色体末端发生错误融合,引发癌变。但是,细胞每分裂一次,端粒就会丢失一部分;在细胞衰老过程中端粒逐渐变小。端粒酶可利用某段RNA序列作为模板合成端粒DNA,对端粒有延伸作用。

(1)染色体末端发生错误融合属于 变异,结果使染色体上基因的 和 发生改变。
(2)端粒酶的作用是 ,所以从功能上看,属于 酶。
(3)随着细胞中端粒长度的缩短,细胞的增殖能力将逐渐 。
(4)科学家发现精子中的端粒长度与受试者的年龄无关。这可能是因为精细胞中
。
(5)癌变的细胞中不仅具有较高活性的端粒酶,细胞膜表面也会出现一些不同于正
常细胞的蛋白质,这些蛋白质会成为 ,引起机体的免疫应答。在应答中可直接与癌细胞密切接触并使之裂解的免疫细胞是 。除常规的治疗方法外,通过寻找能够 癌细胞中端粒酶活性的物质也使癌症的治疗成为可能。
29.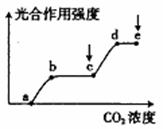 (5分)右图表示叶片的光合作用强度与植物周围空气
(5分)右图表示叶片的光合作用强度与植物周围空气
中的CO2浓度的关系,ce段是增大了光照强度后测得的
曲线。请回答:
(1)影响图中曲线ab段和bc段叶片光合作用强度的主要
环境因素分别是 和 。
(2)如在e点后再次增大光照强度,则曲线能否持续上升?
,原因是 。
28.(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”=。
③ 在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,通过反应I达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)
ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol CO和液态水放出的热量为
(3)利用甲醇燃料电池设计如右图所示的装置:
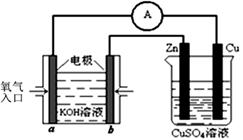
则该装置中Cu极为 极;写出b极的电极反应式 。
当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为 L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com