
56、二氧化氧(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。其制备方法很多。其中常见的方法有:
(1) NaClO3+ H2O2+ H2SO4→ ClO2↑+ Na2SO4+ O2↑+
①请完成并配平该化学反应方程式;
②该反应中的氧化剂是 ,氧化产物是 ;
③每产生11.2L氧气(标准状况下),转移电子的物质的量为 mol;
(2)草酸(H2C2O4)在酸性条件下还原氯酸钾法,该反应的离子方程式为 ;
 (3)电解法,所用的电解质溶液是NaClO2溶液,采用隔膜电解技术制取ClO2,反应的方程式为2NaClO2+2H2O
(3)电解法,所用的电解质溶液是NaClO2溶液,采用隔膜电解技术制取ClO2,反应的方程式为2NaClO2+2H2O 2ClO2↑+2NaOH+H2↑,实验装置如图
2ClO2↑+2NaOH+H2↑,实验装置如图
所示。请回答以下问题:
①N极为电源的 极;
②阴极的电极反应式是 ;
③当产生0.1 mol ClO2时,外电路转移电子数
为 mol。
答案:(1)①2,1,1,2,1,1,2H2O(3分)
②NaClO3;O2(2分) ③1(2分)
(2)2ClO3-+H2C2O4+2H+===2ClO2↑+2CO2↑+2H2O(3分)
(3)①负(1分) ②2H2O +2e- = H2↑ +2OH- (2分) ③0.1(2分)
55、
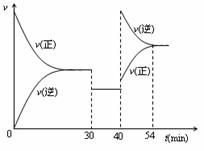
 有体积相等的甲、乙二个密闭容器,如右图所示,甲的活塞可以随意推拉,乙为恒容。向甲容器中充入等物质的量的A和B,一定温度下发生反应,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。
有体积相等的甲、乙二个密闭容器,如右图所示,甲的活塞可以随意推拉,乙为恒容。向甲容器中充入等物质的量的A和B,一定温度下发生反应,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。
(1)20min前A的平均反应速率为 。
(2)写出反应的化学方程式 。
(3)30min-40min间改变的反应条件为 ,请在Ⅱ图中补画出30min-40min间正、逆反应速率图像。
(4)该反应的正反应为 热反应(填吸、放),作出判断的理由是 。
(5)若向乙容器是充入等物质的量的A和B,使A、B的起始浓度均为4.0 mol/L,一定温度下达到平衡后,C的浓度为 mol/L,A的体积分数为 。
(6)若向乙容器是充入一定量的A、B、C,使A、B起始浓度均为a mol/L,C为3.5 mol/L,一定温度下达到平衡时,C的浓度为2 mol/L,则a= 。
 答案:(每空2分)
答案:(每空2分)
(1)0.05mol/(L·min) (2)A(g) + B(g)  2C(g)
2C(g)
(3)增大容器体积,或减小压强
(4)放; 40min时正逆反应速率均增大,且V正<V逆,说明升高温度平衡向逆向移动,则正反应为放热反应。
(5)4 mol/L; 25%
(6)0.25 mol/L
54、某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
|
可能大量含有的阴离子 |
I‑ ClO‑ AlO2- SO42- |
 往该溶液中逐滴加入0.5mol/LBa(OH)2溶液,产生沉淀的物质的量(
往该溶液中逐滴加入0.5mol/LBa(OH)2溶液,产生沉淀的物质的量( )与加入Ba(OH)2溶液的体积(V)的关系如右图所示。
)与加入Ba(OH)2溶液的体积(V)的关系如右图所示。
(1)则该溶液中肯定含有的离子有_______________;肯定不存在的离子有___________。不能确定是否含有的离子有__________,要确定其存在可补充做的实验步骤是 ;
(2)a点数值为 。
(3)OA段反应的离子方程式为 。
(4)D点是沉淀的质量为 。
(1)H+ 、NH4+ 、Al3+、 I‑ 、SO42-; ClO‑ 、 AlO2-; K+;做焰色反应,透过蓝色的钴玻璃若看到紫色的火焰,则证明有K+。 (2)600
(3)Ba2++2OH-+2H++ SO42-=BaSO4+H2O或Ba2++ SO42-=BaSO4,OH-+H+=H2O (4)46.6g
53、A、B、C、D、E、X为中学化学常见物质,存在下图转化关系 (部分生成物和反应条件略去)。
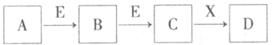
Ⅰ.若D是一种强酸,A是化合物,且D可与铜反应生成B或C
(1)写出A→B化学方程式 。
(2)写出D与铜反应生成C的离子方程式 。
Ⅱ.若D为NaCl,且A可与C反应生成B
(3)E可能的分子式为 。
(4)若E为非极性分子,E的电子式为 ,
(5)C溶液中各离子浓度由大到小顺序 。
Ⅲ.若D与盐酸反应生成A和B
(6)写出C→D化学方程式 。
(7)检验B中阳离子的实验方法为 。
答案:(1) 4NH3+5O2=4NO+6H2O (2) Cu + 4H+ + 2NO3- = Cu2+ + 2NO2 + 2H2O
(3)CO2或SO2或H2S (4) :O::C::O:
(5) C( Na+)>C( HCO3-)>C([OH-)> C( H+) > C( CO32-)
(6)3Fe+2O2=Fe3O4或3Fe+4H2O=Fe3O4+4H2
(7) 取少量B溶液于试管中,滴入 KSCN溶液无现象,再滴入几滴新配制的氯水,溶液变血红色,证明有Fe2+。
52、某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆


(1)A物质的名称为:________________。写出三种属于芳香烃类的A的同分异构体______________________、______________________、__________________。(不包括A,写结构简式)
(2)J中所含的含氧官能团的名称为_____________________________________。
(3)E与H反应的化学方程式是__________________________;反应类型是__________。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是_______________。

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式。
①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。________________________________________
☆
(1)乙(基)苯(2分), (3分)
(3分)
(2)(酚)羟基、羧基(2分) (写对一个给1分,写错不得分)
(3)
 (2分)
(2分)
酯化(取代)反应(2分)
(4)聚苯乙烯(2分)
(5) 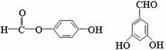 等(4分)
等(4分)
51、I. 有机化合物A 一E的转化如下列反应框图所示,1molA和2molH2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数为65%。
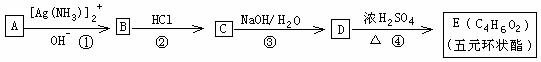
(1)X的分子式为____________________
(2)A分子中所含官能团的名称是_____________________________
(3)上述转化①一④步反应中,属于取代反应类型的是__________________
(4)C的结构简式为_________________________
(5)D→E的反应方程式为_________________________________
II 有机物A的相对分子质量为198.5,其结构简式如下(-R-代表某种烷基),已知在光照条件下,A分子中的一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有下图所示的反应关系:
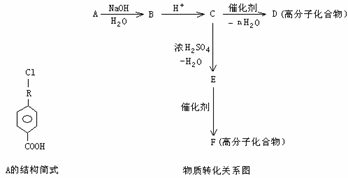
(1)A的分子式为______________
(2)A→B的化学方程式为________________________________________________
(3)写出E中所含官能团的名称____________________;C→D的反应类型_________________
(1) C4H10O (2)醛基 碳碳双键 (3) 3、4
(4)CH2Cl CH2 CH2CH2COOH 2分
(5)HOCH2
CH2 CH2CH2COOH 
 + H2O (1)C10H11O2Cl
+ H2O (1)C10H11O2Cl
(2)

(3)碳碳双键 羧基 各1分 聚合反应(缩聚反应) 1分
50、 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC = -lg10-3 = 3。已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC = -lg10-3 = 3。已知H2CO3溶液中存在下列平衡:







右图为 、
、 、
、 在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题:
在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。请回答下列问题:
(1)在pH
= 9时, 溶液中浓度最大的含碳元素离子为_______________。
溶液中浓度最大的含碳元素离子为_______________。
(2)pH<4时,溶液中 的pC值总是约等于3的原因是_______________。
的pC值总是约等于3的原因是_______________。
(3)一定浓度的NaHCO3和NaCO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化都不大,请用离子方程式表示加入少量强碱后其pH变化不大的原因______________。
(5)若某溶液中含3mol Na2CO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_______________mol。
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_______________mol。

49、汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟汽车尾气处理中CO和NOX的反应并测量反应后混合气体的组成。(已知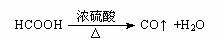 )
)
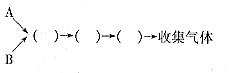 试回答下列问题:
试回答下列问题:
(1)仪器的连接顺序为
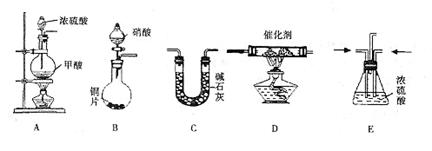
(2)E装置的作用是___________________、___________________。
(3)写出D中的NOX与CO反应的化学方程式______________________________________。
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________。
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:___________________________________________。
48、已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
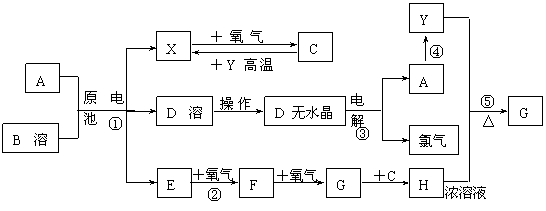
请填写下列空白:
⑴反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式_________________ 。
⑵从D溶液制备D的无水晶体的“操作a”为 ________________________ 。
⑶反应②的化学方程式为 ________________________ 。
⑷反应⑤的化学方程式为 ________________________ 。
⑸原电池反应①中正极的电极反应式为 ________________________
.(1)2Mg+CO2===2MgO+C; (2分) (2)将D溶液在HCl气流中蒸干;(2分)
(3)②4NH3+5O2
 4NO+6H2O; (2分)
4NO+6H2O; (2分)
(4)⑤C+4HNO3(浓) CO2↑+4NO2↑+2H2O
(2分)
CO2↑+4NO2↑+2H2O
(2分)
(5)2NH4++2e- = 2NH3↑+H2↑ (2分)
47、Ⅰ.在恒温恒容下
向一体积为2L的密闭容器中,充入4molA和6molB,发生反应A(g)
+ 3B(g)  2C(g),
2C(g),
10min后达到平衡,测得混合气中C的体积分数为25%。
(1)以A表示此反应的反应速率为 。
(2)平衡时B的转化率为 。
(3)若开始时充入xmolA、ymolB、1.5molC保持上述条件不变,达到平衡时C的体
积分数为仍25%。则x= ,达到平衡前的反应速率V正 V逆(填﹥、﹤、﹦)。
Ⅱ.若维持温度、压强不变
(4)在一个起始体积仍为2L的密闭容器中充入4molA和6molB,当达到平衡时,测得生成nmolC,且C的体积分数为w%。则w% 25%。
a 大于 b 小于 c 等于 d 无法确定
理由是 。
(5)若开始时充入1.5molA、1.5molB、1molC,求达到平衡时生成C的物质的量是 mol
(6)若在(5)的平衡混合物中再加入2molA、3molB,则达平衡时C的体积分数为 。
(1)0.05mol∕(L·min) (2)50% (3)3.25,﹥
(4)A (1)相对于(4)是减压,减压平衡向逆向移动,w%大于25%
(5)n/2 (6) w%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com