
32.(5分)初生牛犊自身免疫力低,必须到4周龄以后,才开始具备自身特异性免疫力.然而初生牛犊能够通过初乳从母体获得这种免疫.所谓初乳,即母牛分娩后5-7天内产生的乳,与常乳比较其特点主要是:①免疫球蛋白比常乳高20-25倍;②初乳中含有四种蛋白酶抑制素,可保护免疫球蛋白不被消化而直接吸收.试回答如下问题:
(1)免疫球蛋白在免疫学中又被称为_________,它们在机体中的作用是__________。
(2)初乳中若不存在蛋白酶抑制素,进入消化道中的免疫球蛋白会被______分解成多肽。
(3)极少数牛犊服用初乳后出现过敏反应,此时的初乳被称为___________________.这种过敏反应发生在____________ (“初次””再次”)服用初乳时。
31. (11分)右图是玉米在适宜的培养条件下实验装置示意图。请回答:

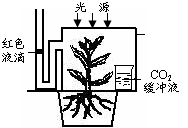 (1)该实验装置中红色液滴的移动量代表____________。
(1)该实验装置中红色液滴的移动量代表____________。
(2)如果密闭装置内提供的是C18O2,那么培养一段时
间后,下列有关18O的转移途径正确的是____。
 A.C18O2→C4→C6H1218O6
A.C18O2→C4→C6H1218O6
B.C18O2→C3→C4→C5
C.C18O2→C4→C3→C6H1218O6
D.C18O2→C3→C4→C6H1218O6
(3)若要验证植物呼吸作用产生了CO2,应对上图中的实验装置进行的操作是: 。
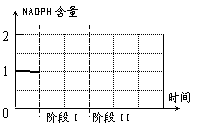 (4)如果在植物叶绿体中的NADPH与NADP+含量大致相等的情况下,依次进行下面两项实验研究:
(4)如果在植物叶绿体中的NADPH与NADP+含量大致相等的情况下,依次进行下面两项实验研究:
阶段Ⅰ 将上述实验装置放在极弱的光照下。
阶段Ⅱ 将实验装置图中的CO2缓冲液换成
浓NaOH溶液,并给予充足的光照。
请你在右面坐标图中画出叶绿体中NADPH
含量的变化曲线。
30.(16分)
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂。C10H12O2,其分子模型如右图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
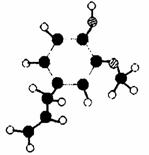 请回答:
请回答:
(1)根据右图模型写出有机物A的结构简式_________
(2)有机物A能发生的化学反应有(填序号)___________
①加成反应 ②水解反应 ③加聚反应
④消去反应 ⑤氧化反应
(3)写出满足下列条件的A所有的同分异构体的结构简式
①能与碳酸氢钠溶液反应;②苯环上的一氯取代物有1种
_____________________________________
(4)已知:(如图)
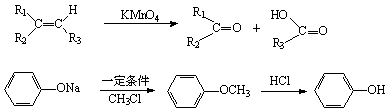

①试剂I不可选用的是(填字母)_____________
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d. Na2CO3溶液
②在上述转化过程中,设置步骤A→N的目的是_________________________
③写出P生成Q的化学方程式________________________________________
④写出W的结构简式__________________________________
29.(14分)
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g); △H= +67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H= -1135.7kJ/mol
则肼完全燃烧的热化学方程式为_________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。该电池放电时,正极的电极反应式是____________________________,电池工作一段时间后,电解质溶液的pH将_________(填“增大”、“减小”、“不变”)。
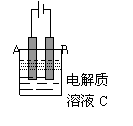 (3)右图是一个电化学装置示意图。用肼--空气燃料电池
(3)右图是一个电化学装置示意图。用肼--空气燃料电池
做此装置的电源。如果A是铂电极,B是石墨电极,
C是AgNO3溶液,若B极增重10.8g,该燃料电池理
论上消耗_____molN2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示
肼的水溶液显碱性的原因_____________。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)_________0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为_________________________________
28.(16分)
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
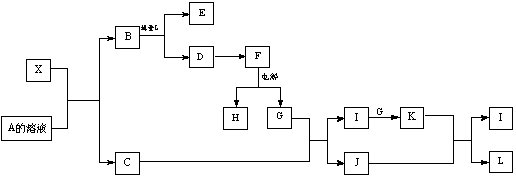
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应呈黄色。回答以下问题:
(1)写出X的化学式:__________,X属于_________晶体,C的空间构型________
(2)由B制备D,为防止D的溶解最好加入(或通入)____________,写出该反应的离子方程式_______________________________________________;
(3)写出X与A溶液反应的化学方程式:_____________________ ___;
写出K与J反应的离子方程式:________________________________ _。
(4)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
 +2N2
+2N2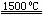 4X+SiC+3C。
4X+SiC+3C。
27.(14分)
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
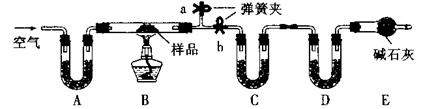
(1)实验时,B中发生反应的化学方程式为__________________________;
_____________________________。
(2)装置C、D中盛放的试剂分别为:
C____________,D____________(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是_____________,它在该实验中的主要作用是_____________;
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________
(填“偏高”、“偏低”或“无影响”)
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是_____________。
26.(21分)
如图所示,带电粒子(电量q,质量m)由静止开始,从电极K在加速电压为U的加速电场中加速后从极板M的小孔S中水平向右射入右侧的圆形匀强磁场中,已知圆形磁场的圆心恰好在KS连线的延长线上,磁感应强度为B,带电粒子穿出磁场区域后速度方向与进入磁场前偏转了θ角。求:
(1)此时圆形磁场区域的半径的大小为多少?
(2)如果适当调整磁场圆心的位置和磁场半径大小,可以保持粒子仍然沿着原来的轨迹运动。则调整后圆形磁场半径的最小值是多少?
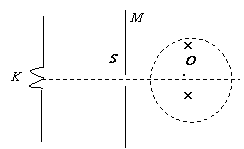 (3)要使带电粒子在此磁场中运动时的偏转角最大,则此圆形磁场需转过多少度?最大偏角是多大?
(3)要使带电粒子在此磁场中运动时的偏转角最大,则此圆形磁场需转过多少度?最大偏角是多大?
25.(18分)
质量为m的木块在质量为M的长木板中央,木块与长木板间的动摩擦因数为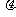 ,木块和长木板一起放在光滑水平面上,并以速度v向右运动。为了使长木板能停在水平面上,可以在木块上作用一时间极短的冲量。试求:
,木块和长木板一起放在光滑水平面上,并以速度v向右运动。为了使长木板能停在水平面上,可以在木块上作用一时间极短的冲量。试求:
(1)要使木块和长木板都停下来,作用在木块上水平冲量的大小和方向如何?
(2)木块受到冲量后,瞬间获得的速度为多大?方向如何?
(3)要使木块停在木板上,长木板的长度要满足什么条件才行?

24.(15分)
一质量为 M=5kg的斜面放在光滑水平面上,斜面高度为H=1m,M与m之间摩擦因数为0.8,m的质量为1kg,起初m 在M竖直面上的最高点.现在使M受到一个大小为60N的水平恒力F的作用,并且同时释放m, F作用持续了0.5s后撤去。求从撤去F到m落地,M的位移为多少?
23.(12分)如下图所示电路能够测量电源E的电动势和内阻r,E′是辅助电源,A、B两点间有一灵敏电流计G。
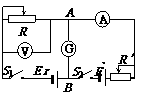 (1)补充下列实验步骤:
(1)补充下列实验步骤:
①闭合开关S1、S2,调节R、R′的值使得________。
这时A、B两点电势UA______UB,(填大于、小于
或等于)即A、B相当于同一点。读出电流表和电
压表的示数I1和U1,其中I1就是通过电源的电流。
②改变滑动变阻器R、R′的值,重新使得_____________,读出____________
(2)写出由①、②对应的方程式得出的电动势和内电阻的表达式_______________
(3)说明此方法的优点_______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com