
17.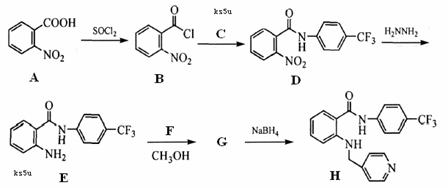 (14分)新一代药物H具有良好的抗肿瘤活性,其合成路线如下:
(14分)新一代药物H具有良好的抗肿瘤活性,其合成路线如下:
已知: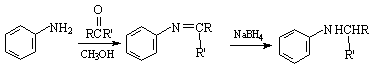
反应物中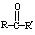 ,R、R’可为:H、CH3、NH2等。
,R、R’可为:H、CH3、NH2等。
(1)A→B的反应类型是 ▲ 。
(2)写出C的结构简式 ▲ 。
(3)物质D发生水解反应的方程式为 ▲ 。
(4)写出E→G的反应方程式 ▲ 。
(5)写出符合下列条件的物质A的同分异构体的结构简式 ▲ 。
①属于硝酸酯 ②苯环上的一氯代物有两种
(6)苯并咪唑类化合物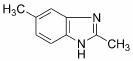 是一种抗癌、消炎药物。利用题给相关信息,以
是一种抗癌、消炎药物。利用题给相关信息,以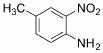 、CH3COCl、CH3OH为原料,合成过程中无机试剂任选;合成路线流程图示例如下:
、CH3COCl、CH3OH为原料,合成过程中无机试剂任选;合成路线流程图示例如下:
 CH3CH2OH
CH3CH2OH
 H2C=CH2
BrH2C-CH2Br
H2C=CH2
BrH2C-CH2Br
▲
16.(10分)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 ▲ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 ▲ 。该工艺选择氯气的优点是 ▲ 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为 ▲ mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为 ▲ mg/L。
15.(10分)电镀废水一种特殊处理工艺如下:
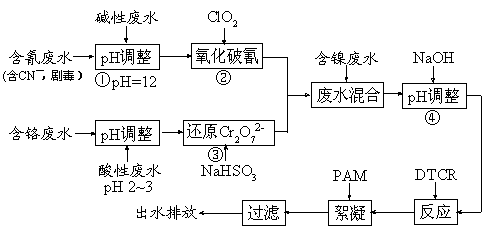
图中DTCR能与Ni2+、Zn2+、Cu2+、Cr3+等各种重金属离子迅速反应,生成不溶水的螯合盐,再加入少量絮凝剂下,形成絮状沉淀,从而达到捕集去除重金属的目的。
试回答下列问题:
(1)步骤②ClO2可将CN-直接氧化成两种无毒气体,该反应的离子方程式为 ▲ 。
(2)若含氰废水流量为0.8 m3/h,含氰(CN-)浓度为300 mg/L,为确保安全,实际投放ClO2为理论值的1.3倍,则完成氧化每小时共需投入ClO2质量为 ▲ kg。
(3)步骤③中氧化剂与还原剂的物质的量之比为 ▲ 。
(4)PAM为丙烯酰胺(CH2=CHCONH2)的聚合物,该聚合物的结构简式为 ▲ 。
(5)本工艺中将废水分类收集,分而治之的优点是 ▲ 。
14. (10分)实验室用共沉淀法制备纳米级Fe3O4的流程如下:

该方法的关键为促进晶粒形成,并控制晶体生长。试回答下列问题:
(1)该反应原理的离子方程式可表示为 ▲ 。
(2)反应温度需控制在50℃,其方法是 ▲ ,温度偏低造成产量低的可能是 ▲ 。
(3)在搅拌Ⅱ的过程中还需加入10 mL正丙醇,其作用是 ▲ 。
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是 ▲ 。
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条) ▲ 。
13.(12分)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环
境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为
BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的
pH分别是:3.4、12.4。 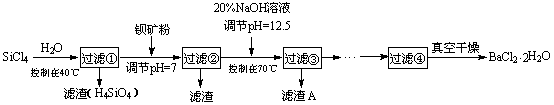
(1)SiCl4水解控制在40℃以下的原因是 ▲ 。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则由SiCl4制备硅的热化学方程式为 ▲ 。
(2)加钡矿粉时生成BaCl2的离子反应方程式是 ▲ 。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是 ▲ ,控制温度70℃的目的是 ▲ 。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。实验室中蒸发浓缩用到的含硅酸盐的仪器有 ▲ 种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是 ▲ 。
12.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g D.V=448
非 选 择 题(共78分)
11.下列溶液中有关微粒浓度的关系不正确的是
A.向0.2 mol/L KA溶液中加入等体积的0.1 mol/L HCl溶液,得pH=10的混合溶液:
c(K+)>c(HA)>c(Cl-)>c(A-)
B.c1 mol/L pH=a的醋酸,c2 mol/L pH=b的醋酸,若a+1=b,则c1 >10 c2
C.浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
D.某二元弱酸的酸式盐NaHA溶液:c(H+)+c(H2A)=c(OH-)+c(A2-)
10. 铅蓄电池(如图)的总反应式为:PbO2+Pb+2H2SO4 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A. 放电时,H2SO4 浓度降低
B. 充电时,电源正极与蓄电池的“-”极连接
C. 负极的电极反应式为:Pb+SO42--2e- =PbSO4
D. 因PbSO4难溶,铅蓄电池报废后无需回收处理
9. T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是
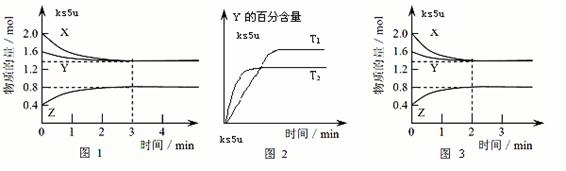
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂
8.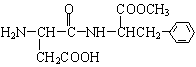 如图是一种人工合成的甜味剂aspartame的结构简式,比一般的蔗糖甜160倍,由于它不会被消化而变为能量供给身体所需,所以适合一些减肥人士食用,目前是糖的最佳代用品。下列关于aspartame的描述正确的是
如图是一种人工合成的甜味剂aspartame的结构简式,比一般的蔗糖甜160倍,由于它不会被消化而变为能量供给身体所需,所以适合一些减肥人士食用,目前是糖的最佳代用品。下列关于aspartame的描述正确的是
A.不能使酸性高锰酸钾溶液褪色
B.分子式是C14H19N2O5
C.具有2个手性碳原子
D.1 mol该物质与NaOH溶液反应,最多消耗3 mol NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com