
9.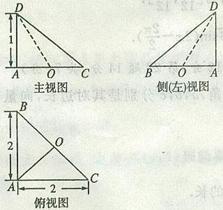 已知F1、F2分别是双曲线
已知F1、F2分别是双曲线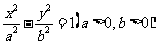 的左、右焦点,P为双曲线上的一点,若
的左、右焦点,P为双曲线上的一点,若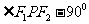 ,且
,且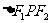 的三边长成等差数列,则双曲线的离心率是()
的三边长成等差数列,则双曲线的离心率是()
A.2 B.3 C.4 D.5
8.已知函数f(x)=alog2x+blog3x+2,且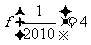 ,则f(2010)的值为()
,则f(2010)的值为()
A.-4 B.2 C.-2 D.0
7.等差数列{an}的前n项和为Sn,若Sn=35,点A(3,a3)与B(5,a5)都在斜率为-2的直线l上,则Sn的最大值为()
A.16 B.35 C.36 D.32
6.已知m、n是两条不同的直线,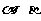 是两个不同的平面,有下列4个命题:
是两个不同的平面,有下列4个命题:
①若m//n,n ,则m//
,则m// ;
;
③若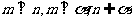 ,则n//
,则n//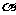 ;
;
③若 ,则
,则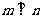 ;
;
④若m、n是异面直线,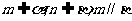 ,则n//
,则n//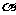 。
。
其中正确的命题有()
A.①② B.②③ C.③④ D.②④
5.直线l与圆x2+y2+2x-4y+a=0(a<3)相交于A、B两点,若弦AB的中点为(-2,3),则直线l的方程为()
A.x-y+5=0 B.x+y-1=0 C.x-y-5=0 D.x+y-3=0
79. 已知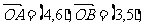 且
且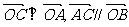 ,则向量
,则向量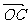 等于()
等于()
A.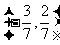 B.
B.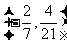 C.
C.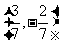 D.
D.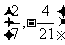
3.“毒奶粉”事件引起了社会对食品安全的高度重视,各级政府加强了对食品安全的检查力度,某市工商质检局抽派甲、乙两个食品质量检查组到管辖区域内的商店进行食品质量检查,右图表示甲、乙两个检查组每天检查到的食品品种数的茎叶图,则甲、乙两个检查组每天检查到的食品种数的中位数的和是()
A.56 B.57 C.58 D.59
2.下列命题错误的是()
A.命题“若x2-3x+2=0,则x=1”的逆否命题为“若x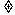 1,则x2-3x+2
1,则x2-3x+2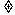 0”
0”
B.若命题 ,则
,则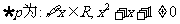
C.若p q为假命题,则p,q均为假命题
q为假命题,则p,q均为假命题
D.“X>2”是“x2-3x+2>0”的充分不必要条件
1.若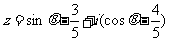 是纯虚数,则
是纯虚数,则 的值为()
的值为()
A.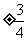 B.
B.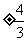 C.
C.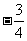 D.
D.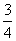

18. (10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
▲
选做题(本题包括1小题,共12分)
下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
19(A)(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 ▲ 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 ▲ 晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 ▲ 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ▲ ,原因是 ▲ 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ▲ ,分子的空间构型为 ▲ 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 ▲ 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com