
2、 在下列个小题的横线上,写出相应的诗文名句或作家作品。(10分)
① ,思而不学则殆。 (《论语》)
② ,蜡炬成灰泪始干。 (李商隐《无题》)
③ 受任于败军之际, ,尔来二十又一年矣。(诸葛亮《 》)
④安得广厦千万间,
 ,大庇天下寒士俱欢颜。( 《茅屋为秋风所破歌》)
,大庇天下寒士俱欢颜。( 《茅屋为秋风所破歌》)
⑤蒹葭苍苍, 。所谓伊人, 。(《诗经·蒹葭》)
⑥剪不断,理还乱,是离愁,
 。 (李煜《相见欢》)
。 (李煜《相见欢》)
⑦落红不是无情物, 。 (龚自珍《己亥杂诗》)
1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。

27. (15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
[应用研究]
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
[制备研究]
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
[Na2CO3质量分数测定]
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
 (3)装置A的作用是_____。设计的实验步
(3)装置A的作用是_____。设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。
计算碳酸钠含量至少需要测定______
(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因
_______。
|
精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3 → 3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
 (4)检查该装置气密性的方法是连接好装置,从水准瓶
(4)检查该装置气密性的方法是连接好装置,从水准瓶
注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是
______。
(6)使用冷水冷凝的目的是______。反应前应将液面调
节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为
26.(10分)某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物。
(1)两溶液混合生成蓝色沉淀的化学方程式是_______。沉淀放置一段时间后,完全变为黑
 色沉淀,猜想是CuO。为验证猜想,将沉淀过滤、洗涤、烘干后,用CO还原得到红色物质,且生成的气体能使________,写出CO与CuO反应的化学方程式________。
色沉淀,猜想是CuO。为验证猜想,将沉淀过滤、洗涤、烘干后,用CO还原得到红色物质,且生成的气体能使________,写出CO与CuO反应的化学方程式________。
(2)CuSO4溶液与NaOH溶液反应有时也会生成浅绿色沉淀 [化学
式为CuSO4·3Cu(OH)2]和Na2SO4,则反应方程式为________。
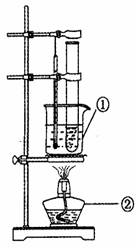
(3)为探究新制Cu(OH),的分解温度,设计水浴加热装置(如
图)。
写出仪器的名称:①_______②_______。该装置采用水浴加热,其目的是_______。
(4)18℃时,将溶质质量分数均为10%的CuSO4溶液与NaOH溶液
混合后,测得混合液温度为22℃,说明该反应_____(填“放热”或“吸热”)。当水浴温度分别为30℃、60℃、90℃时,黑色沉淀出现的时间为:2分钟、6秒、1秒,则说明温度越高,Cu(OH)2分解速率越_____(填“快”或“慢”)。该实验说明,Cu(OH)2分解温度________(填“无确定数值”或 “有确定数值”)。
25. (10 }) 能源“非石油化”是战略目标,发展以CH4 、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下图为天然气合成氨的工艺流程。
 (1)甲烷----氧气燃料电池是将______能转化为______能的装置。CH4在空气中燃烧时,将
(1)甲烷----氧气燃料电池是将______能转化为______能的装置。CH4在空气中燃烧时,将
干冷的小烧杯罩在火焰上方,可观察到烧杯内壁有______。
(2 )CH4可合成多种无机物和有机物。研究CH4和CO2反应生成CO和H2,重大意义在
于______;我国科研人员首先发现CH4可直接分解获得C6H6和H2,化学方程式为
___________。
(3)①中CH4与H2O(气)反应生成CO2、H2,化学方程式是______。②中一般加人K2CO3
溶液吸收CO2,此反应表示为K2CO3+CO2+H2O = 2_________,N2 与 H2按照分子
数1:____反应生成NH3。
(4)使用Fe2O3·H2O除去H2S,生成物中含硫元素的物质有______种。流程中参与循环
的物质是_______(填化学式)。
24.(8分)烟花爆竹的主要成分是黑火药,其化学组成为硝酸钾、硫磺和木炭等。
(1)黑火药中至少有_______种元素,欲分离出硝酸钾,可进行______、过滤、蒸发结晶等操作。
(2)黑火药的一般配方是:硫磺2 g、硝酸钾3 g、炭粉4. 5 g。已知黑火药在空气中燃爆时可
发生:S + 2KNO3 + 3C = K2S + 3CO2↑+ N2↑,则S、KNO3、C完全反应时的质量比为
_______,该配方中C和_____(填化学式)明显过量。燃放烟花爆竹产生SO2的反应方程式是_________。
(3)SO2气体在空气中经粉尘催化氧化为SO3 , SO3与水反应,形成硫酸型酸雨,写出有关
反应的化学方程式:____________,_____________。
(4)很多城市出台“禁放”规定杜绝此类污染,以下解决“现代文明”与“传统文化”冲突的做法可行的是_______。(填字母)A.提倡电子鞭炮 B.开发绿色鞭炮 C.关停鞭炮企业
23. (5分)如图为速力菲补血剂的说明书。
(5分)如图为速力菲补血剂的说明书。
(1)蔗糖(C12H22O6)在酶的催化作用下与水作用
只生成葡萄糖(C6H12O6 ),则1分子蔗糖完全与水作用可得_____分子葡萄糖。若向速力菲的溶液中滴加碘水,将呈现_____色。
(2)琥珀酸亚铁的相对分子质量为_____,成人
每日1片速力菲,每日的补铁量为_____g。
(3)丁二酸钠(Na2C4 H4O4)与硫酸亚铁发生复分
解反应可制得琥珀酸亚铁,则反应方程式为
__________。
22. (6分)人类对原子结构的认识永无止境。
(6分)人类对原子结构的认识永无止境。
(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生
认为原子是“嵌着葡萄干的面包”,如今这些观点均
_____(填“正确”或“错误”),卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带
_____ 电荷的原子核和核外电子构成。
 道尔顿汤姆生卢瑟福
道尔顿汤姆生卢瑟福
(2)右下图是元素周期表的一部分(数字表示相应元素的原子序数)。表中部分元素的原子
(离子)结构示意图如下,其中属于阳离子的是_____(填数字序号)。
选用表中元素填空A2B2型化合物的化学式是_________,带一个单位负电荷的一种阴离子_______。某耐火材料是由Mg, O组成的化合物,写出其化学式_________。
21.(6分)化学知识与生活联系密切。请用下列物质的数字序号填空。
①醋酸(CH3COOH) ②纯碱 ③尿素[CO(NH2)2] ④活性炭 ⑤食盐 ⑥维生素C
(1)家庭制作馒头添加的“碱”_______ (2)除去铝壶中的水垢 _______
(3)腌制鱼肉等常用的调味品 _______ (4)除去冰箱异味 _______
(5)常吃蔬菜水果可补充的物质 _______ (6)含氮量最高的常用氮肥 _______
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com