
1.下列词语中,字形和加点字的读音全都正确的一项是 ( )
A.拖踏 没齿不忘 肖(xiào)像 宁(níng)缺毋滥
B.犀利 牵强附会 哽咽(yè) 怙恶不悛(quān)
C.筹办 若既若离 稽(jī)首 退避三舍(shè)
D.消禁 闲情逸致 属文(zhǔ) 数(shù)见不鲜
31.(18分)某科研单位在调查湖水中细菌的污染情况进行了实验。实验包括制备培养基、灭菌、接种及培养、菌落观察计数。
 (1)培养基中含有蛋白胨、淀粉分别为细菌培养提供了 。对培养基进行灭菌,应该采用的方法是
。接种时通常采用
方法,把聚集的菌种逐步分散到培养基的表面。如果提高培养基中NaCl的浓度,可以用于筛选耐盐细菌,这种培养基被称为
。
(1)培养基中含有蛋白胨、淀粉分别为细菌培养提供了 。对培养基进行灭菌,应该采用的方法是
。接种时通常采用
方法,把聚集的菌种逐步分散到培养基的表面。如果提高培养基中NaCl的浓度,可以用于筛选耐盐细菌,这种培养基被称为
。
(2)该细菌所含的耐盐基因可通过酶切法获取,
作为基因工程中的目的基因导入小麦中,其
过程如右图所示。其中A为 ,耐
盐基因的小麦细胞还应经过 ,在此
过程中还将使用 两种植物激素,
从而最终可获取含耐盐基因的小麦植株,当
然这些小麦植株并不一定具有耐盐的特性,这
是因为 。
(3)图中C还可用于其他工程细菌中,若成功导入大肠杆菌内,则可能使大肠杆菌获得哪些特性? 。
30.(16分)
日本明蟹壳色有三种情况:灰白色、青色和花斑色。其生化反应原理如图所示。基因A控制合成酶1,基因B控制合成酶2,基因b控制合成酶3。基因a控制合成的蛋白质无酶1活性,基因a纯合后,物质甲(尿酸盐类)在体内过多积累,导致成体会有50%死亡。甲物质积累表现为灰白色壳,丙物质积累表现为青色壳,丁物质积累表现为花斑色壳。请回答:
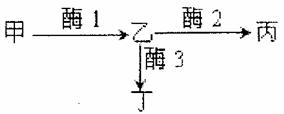
(1)明蟹的青色壳是由 对基因控制的。青色壳明蟹的基因型有 种,分别是 。
(2)两只青色壳明蟹交配,后代成体只有灰白色明蟹和青色明蟹,且比例为1:6。亲本基因型组合为 或 。
(3)基因型为AaBb的两只明蟹杂交,后代的成体表现为 ,其比例为 。
(4)从上述实验可以看出,基因通过控制 来控制代射过程,进而控制生物体的性状。
29.(16分)
某实验小组为了探究细胞膜的通透性,将小鼠肝细胞在体外培养一段时间后,检测培养液中的氨基酸、葡萄糖和尿素含量,发现它们的含量发生了明显的变化(如图)。请回答问题。
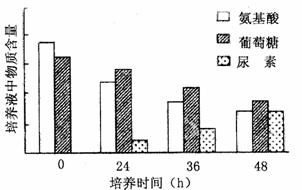
(1)由图可知,随培养时间延长,培养液中葡萄糖和氨基酸含量 ,尿素含量 。由于在原培养液中没有尿素,推则其是 的产物。
(2)培养液中的氨基酸进入细胞后,可用于合成细胞中 、 、 、
(写出四种细胞结构)上的蛋白质。被吸收的葡萄糖主要通过 (生理过程)为细胞提供能量。
(3)转氨酶是肝细胞内参与氨基酸分解与合成的一类酶,正常情况下这类酶不会排出细胞外,若在细胞培养液中检测到该类酶,可能的原因是 。
(4)由(1)和(3)可初步判断,细胞膜对物质的转运具有 的特性。
28.(10分)
 汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
 (1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
K= 。
(2)已知:CO(g)+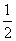 O2(g)+2CO2(g) △H=一283 kJ/mol
O2(g)+2CO2(g) △H=一283 kJ/mol
N2(g)+O2(g)=2 NO(g) △H=+180 kJ/mol
 则反应2NO(g)+2CO(g)
N2(g)+2CO2(g)△H= kJ/mol。
则反应2NO(g)+2CO(g)
N2(g)+2CO2(g)△H= kJ/mol。
 (3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成NaCO3的物质的量为 mol。
27.(16分)
为探究如何尽可能多的使NO:被水吸收,某活动小组设计并完成了以下实验。
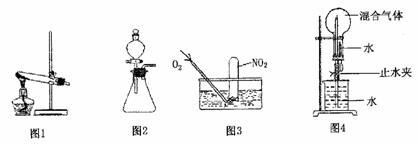
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
①根据反应原理他们选用了相同的装置 (填“图l”或“图2”)分别制取N22和O2。
②写出铜与浓硝酸反应的离子方程式 。
③过氧化氢溶液与MnO2制取O2时MnO2的作用是 。
④收集NO2的方法是 。
(2)活动小组的同学做了如下准备工作:用气囊收集好纯净的O2,收集了一试管NO2,
用干燥的烧瓶收集了一定比例的NO2和O2的混合气体。
①为了尽可能多的使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通人O2相比,其优点是 。
②利用图4吸收气体时,其操作和现象为 。
③NO2、H2O反应的产物为硝酸,反应中NO2和O2物质的量之比a:b= ;若图4中混合气体NO2和O2比例为a:b,当混合气体全部被吸收时所得溶液物质的量浓度为 mol/L(保留两位有效数字)。
26.(16分)
下表为元素周期表的一部分,参照元素①-⑦在表中的位置,请用化学用语回答下列问题:
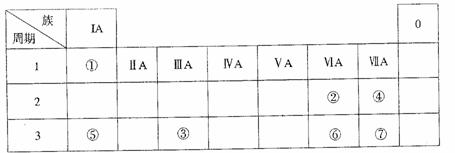
(1)④、⑤、⑦的原子半径由大到小的顺序为 。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
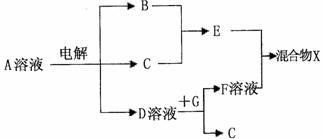
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为完全转化,则混合物x中含有的物质有 。
25.(16分)
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
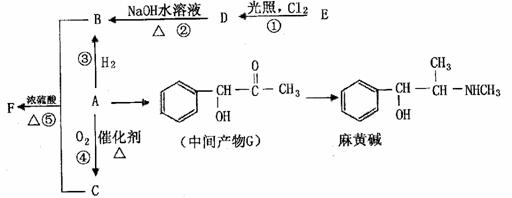
请回答下列问题:
(1)关于麻黄碱下列说法正确的是 (填字母)。
a.麻黄碱的分子式为C15H15NO
b.具有止咳平喘作用,是从中药麻黄中提取的生物碱
c.属于国际奥委会严格禁止的兴奋剂
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量分数之比为42:3:8,
则A的含氧官能团名称是 ;检验该官能团的方法是
(3)反应①-⑤中属于取代反应的是 (填序号)。
(4)写出D-B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
|
|
溶解性 |
沸点 |
|
A |
微溶于水 |
179.0℃ |
|
E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是
。
24.(20分)
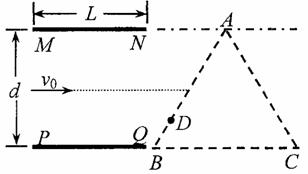
如图所示,两块平行金属板MN、PQ水平放置,两板间距为d、板长为L,在紧靠平行板右侧的等边三角形区域内存在着匀强磁场,磁场方向垂直纸面向里,三角形底边BG与PQ在同一水平线上,顶点A与MN在同一水平线上。
一个质量为m、电量为+q的粒子沿两板中心线以初速度v0水平射入,若在两金属板间加某一恒定电压,粒子离开电场后垂直AB边从D点进入磁场,BD=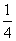 AB,并垂直AC边射出(不计粒子的重力)。求:
AB,并垂直AC边射出(不计粒子的重力)。求:
(1)两金属板问的电压;
(2)三角形区域内磁感应强度大小;
(3)若两金属板问不加电压,三角形区域内的磁场方向垂直纸面向外。要使粒子进入场区域后能从BC边射出,试求所加磁场的磁感应强度的取值范围。
23.(18分)
如图所示,电阻不计的两光滑金属导轨相距L,放在水平绝缘桌面上,半径为R的l/4圆弧部分处在竖直平面内,水平直导轨部分处在磁感应强度为B,方向竖直向下的匀强磁场中,末端与桌面边缘平齐。两金属棒ab、cd垂直于两导轨且与导轨接触良好。棒ab质量为2 m,电阻为r,棒cd的质量为m,电阻为r。重力加速度为g。
开始时棒cd静止在水平直导轨上,棒ab从圆弧顶端无初速度释放,进入水平直导轨后与棒cd始终没有接触并一直向右运动,最后两棒都离开导轨落到地面上。棒ab与棒cd落地点到桌面边缘的水平距离之比为1:3。求:
(1)棒ab和棒cd离开导轨时的速度大小;
(2)棒cd在水平导轨上的最大加速度;
(3)两棒在导轨上运动过程中产生的焦耳热。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com