
31.(7分)(1)实验室要制取二氧化碳,小明同学应该从以下药品中选择 和 反应,反应的化学方程式为 。

(2)选择以上药品的理由是_______(填字母序号)。
A. 反应速率适中,易于收集
B.反应条件要求不高,常温即可反应
C.部分反应物在自然界广泛存在,价格相对便宜
(3)①下图中仪器A的名称是 。
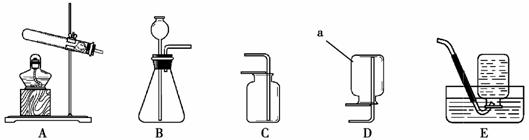 ②实验室要制取一瓶二氧化碳,应选择下列实验装置中的 (填字母序号),不选择另外两种气体收集装置的原因是 。组装好实验装置后,应首先
,再向装置中装入药品。
②实验室要制取一瓶二氧化碳,应选择下列实验装置中的 (填字母序号),不选择另外两种气体收集装置的原因是 。组装好实验装置后,应首先
,再向装置中装入药品。

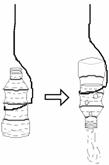 32.(6分)某兴趣小组同学为了弄清即将维修的沼气池中气体的成分,进行了有关实验。请你与他们一起完成以下探究活动。
32.(6分)某兴趣小组同学为了弄清即将维修的沼气池中气体的成分,进行了有关实验。请你与他们一起完成以下探究活动。
[收集气体]将不加盖的矿泉水瓶装满水,用细绳吊入池中,
再用木棍拨动,使瓶中的水全部倒出(见右图),然后迅速拉
起矿泉水瓶,盖上瓶盖。这种收集气体的方法属于  集
集
气法。
[对气体成分进行猜想]
猜想一:全部是CH4;
猜想二:全部是CO2;
猜想三:是CH4和CO2的混合气体。
[实验和推断]实验过程如下:



(1)若“现象a”为石灰水变浑浊,则说明气体中含有 气体。
(2)步骤②的目的是 。
(3)若“现象b”为杯壁有水雾出现,有同学认为“猜想四”成立;另有同学认为此现象不能证明收集到的气体中一定含有氢元素,理由是 ;要排除这种干扰可采取的措施是 。
(4)采取(3)中的排除干扰措施后:若“现象a、b”无明显现象,“现象c”石灰水变浑浊,则证明“猜想 ”成立;若“现象a、c”均为石灰水变浑浊,“现象b”为杯壁有水雾,则证明“猜想 ”成立。
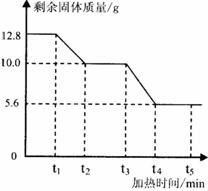 33.(8分)草酸(化学式为CaC2O4)是一种难溶于水的白色固体,受热能分解。小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如右图所示。
33.(8分)草酸(化学式为CaC2O4)是一种难溶于水的白色固体,受热能分解。小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如右图所示。
(1)请回答下列问题:
①t1-t2时间段内固体质量减少的原因是生成了
一种极易与血红蛋白结合的有毒气体,同时生
成一种白色固体,它与大理石的主要成分相同,
则该段时问内反应的化学方程式为 。
②t2-t3时间段内固体质量不变的原因是 。
③t3-t4时间段内反应的化学方程式为 。
(2)小强和小明两位同学另取12. 8g草酸钙固体加热一段时间后,对剩余固体的成分进行探究。
[查阅资料]
CaC2O4能与稀盐酸反应,其反应的化学方程式为:CaC2O4+2HCl=CaCl2+H2C2O4;
草酸(H2C2O4)是一种可溶于水的酸。
[设计方案并实验]
|
同学 |
实验操作 |
实验现象 |
结论 |
|
小强 |
取少量固体放入烧杯中,加适量水并搅拌。静置后,取上层清液于试管中,滴加紫色石蕊溶液 |
溶液变蓝色 |
剩余固体中一定含有 一定不含有 可能含有 |
|
小明 |
另取少量固体放入试管中,加足量稀盐酸 |
有气体产生 |
剩余固体中一定含有 |
[交流与讨论]三位同学经过交流后认为,该剩余固体的质量的取值范围是 。
30.(6分)甲、乙、A、B均为初中化学常见物质,请根据下列叙述回答问题。
(1)若甲能与CO2反应生成一种钠盐,则甲的化学式为 。
(2)若甲分别与两种不同类别的物质反应生成A、B,A、B均由三 种相同元素组成,写出化学方程式:甲→A ;甲→B 。
种相同元素组成,写出化学方程式:甲→A ;甲→B 。
(3)若甲为化合物,甲分别与两种不同类别的物质反应都能生成乙,且乙由三种元素组成,则甲为 ,丙为 ;写出一个属 于复分解反应的化学方程式 。
于复分解反应的化学方程式 。
29.(8分)(1)化学小组同学用下列仪器和试剂,验证金属与盐酸反应速率的影响因素。
实验仪器:烧杯、石棉网、酒精灯、铁架台(带铁圈)、镊子、量筒、天平等。
实验试剂:锌片、铁片、镁片。溶质质量分数分别为5%、20%的盐酸。
①不同金属与酸反应的快慢不同
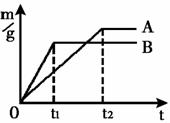 取质量相等的镁、锌、铁中两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线
取质量相等的镁、锌、铁中两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线
如右图所示。则线B对应的金属为 ,线A
对应的金属与稀盐酸反应的化学方程式为 。
②同种金属与不同溶质质量分数的盐酸反应的快慢不同
取两份质量相等的锌片,分别放入5%和20%的足量
稀盐酸中,生成氢气的质量为m,反应时间为t 。对比5%和 20%的稀盐酸分别与锌片反应情况,下列关系曲线正确的是 (填字母序号)。
20%的稀盐酸分别与锌片反应情况,下列关系曲线正确的是 (填字母序号)。
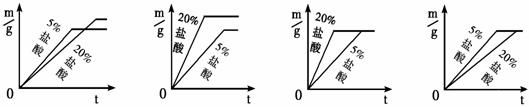


A B C D
实验表明,盐酸中溶质的质量分数越大,与金属反应的速率越快。
③温度对金属与盐酸反应速率也有影响,且实验表明,温度越高,盐酸与金属反应的速率越快。请用控制变量的方法设计实验,验证以上结论,实验方案为 。
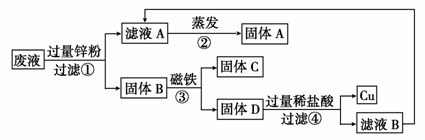 (2)同学们做完实验后,将含有CuCl2、ZnCl2、FeCl2的废液倒在废液缸里,如果将废液直接排放,就会造成水污染。于是几位同学利用课余时间处理废液,回收工业重要原料氯化锌和有关金属。实验过程如下图所示。
(2)同学们做完实验后,将含有CuCl2、ZnCl2、FeCl2的废液倒在废液缸里,如果将废液直接排放,就会造成水污染。于是几位同学利用课余时间处理废液,回收工业重要原料氯化锌和有关金属。实验过程如下图所示。


请回答:
① 滤液A和滤液B含有的一种相同溶质的化学式是 ;
②写出步骤①反应的化学方程式 ;
③检验步骤④中加入的稀硫酸是否过量的方法是 。
28.(4分)为了确保人体健康,需要吃些粗粮。玉米是营养成分丰富的优质粗粮,玉米中的主要成分见下表。
|
成分 |
蛋白质 |
油脂 |
糖类 |
水和维生素B等 |
|
质量分数 |
约10% |
约5% |
约80% |
约5% |
(1)上表中含有人体所需的营养素有 类。
(2)玉米初加工可得到淀粉,淀粉属于 (填字母序号)。
A.蛋白质 B.糖类 C.油脂
(3)淀粉发酵可制得乙醇,乙醇属于 (填字母序号)。
A.最清洁能源 B.不可再生能源 C.可再生能源
(4)玉米芯与稀硫酸在加热、加压的条件下反应,可得到重要的化工原料糠醛。糠醛(C5H4O2)充分燃烧只生成二氧化碳和水,写出此燃烧反应的化学方程式 。
27.(7分)(1)水在实验室和日常生活中有着十分重要的作用。
①在实验室里,水除了可以用来刷洗仪器,还可以 (写出一种用途即可);
②生活中用纱网可将茶叶与茶水分离,便于饮用,其应用 的分离方法在化学上称为
。
的分离方法在化学上称为
。
③自然界的水经过一系列净化处理后,成为比较清洁的自来水。自来水不是纯水,若要制取纯水,应采取的净化方法是 。
④餐具上的油污用自来水很难洗净,往水中滴加少量洗涤剂后,就很容易洗净,因为洗涤剂具有 功能。
(2)氧气是维持生命活动不可缺少的。
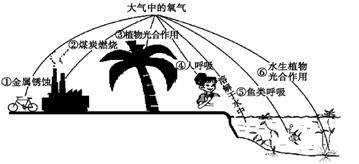 ①下图是自然界中氧的部分循环示意图。从①-⑥中选择序号填空,消耗氧气的有_______,产生氧气的有_______。
①下图是自然界中氧的部分循环示意图。从①-⑥中选择序号填空,消耗氧气的有_______,产生氧气的有_______。
②下列说法正确的是_______(填字母序号)。
A.空气中的氧气含量永远不变 B.氧气有百利而无一害
C.空气中氧气的浓度越高越好
D.氧元素在自然界的存在形式既有单质,又有化合物
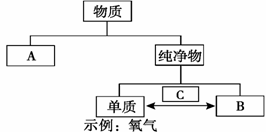
26.(5分)(1)右图表示物质分类和转化关系。
请按要求填空。
①A处物质类别是 ;
②B处物质类别及物质示例是 、 。
③C处对应的是______(填“物理”或“化学”)
变化。
(2)应用质量守恒定律进行判断:
取A、B、C三种物质各20g,在一定条件下充分化合只能生成42g新物质D。若增加5gA,充分反应后原反应物中 只有C剩余。下列说法正确的是 (填字母序号)。
只有C剩余。下列说法正确的是 (填字母序号)。
A. 第一次反应停止后,C剩余14g B. 两次反应后,生成D的总质量为52.5g
C. 反应中A和B的质量比是5︰4 D. 反应中A和C的质量比是10︰3
25.双氧水是过氧化氢的水溶液,一定溶质质量分数的双氧水可用于医疗消毒。某瓶双氧水中氢元素与氧元素的质量比为1∶10,则该瓶双氧水中溶质的质量分数为
|
A.3.1% |
B.30% |
C.35.2% |
D.38.6% |
 二、填空题(共5道小题,共30分。)
二、填空题(共5道小题,共30分。)
24.为研究某镁铝合金的成分,进行甲、乙、丙三组实验。三组各取30g溶质质量分数相同的盐酸溶液,加入该种镁铝合金粉末。每组实验加入合金质量和产生气体质量的有关数据如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(g) |
0.153 |
0.255 |
0.385 |
|
气体质量(g) |
0.015 |
0.025 |
0.03 |
根据表中的数据可判断
A. 甲组盐酸不足量 B. 乙组盐酸不足量
C. 丙组盐酸不足量 D. 甲、乙、丙三组盐酸均过量
23.观察以下化学反应的微观示意图。下列说法不正确的是
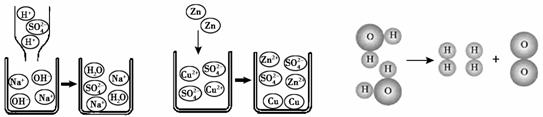
图1 图2 图3
A.图1中的反应,微观上是H+和OH–生成水分子的过程
B.图2中的反应,微观上是锌离子和铜原子生成锌原子和铜离子的过程
C.图3中的反应,微观上是分子破裂成原子,原子重新组合生成新分子的过程
D.上述所涉及的化学反应基本类型有:复分 解反应、置换反应、分解反应
解反应、置换反应、分解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com