
3. 熟记常见元素符号、离子符号、化合价与化学式,明确符号周围数字的含义是求解化合价、书写化学式、进行有关计算的前提。
2. 构成物质的微粒涉及的概念较多,容易混淆,这就要求学习过程中善于运用对比的方法将有关概念进行对比,从而实现明确概念、熟练运用的目的。如可以通过列表比较元素与原子、分子与原子、原子与离子三组概念的区别与联系。
1. 学习物质构成的奥秘这部分知识时,同学们应首先对物质的分类有清楚地认识,要能从组成上区分纯净物和混合物、单质和化合物;要建立宏观和微观的联系,会用微观知识解释宏观现象,并形成“化学变化过程中元素不变”的观念。
6. 计算技能突破
根据化学式进行有关计算的解题关键是善于从化学式中找到计算的关系,确定数量关系。常用的计算公式有(以化合物AmBn为例):
(1)相对分子质量=A的相对原子质量×m+B的相对原子质量×n
(2)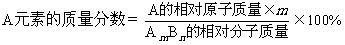
(3)A元素的质量=化合物(AmBn)的质量×该化合物中A元素的质量分数
(4)在混合物中,某物质的质量分数(纯度)=
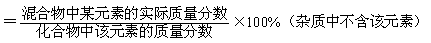
(5)混合物中某元素的质量=的混合物的质量×混合物中该元素的质量分数=混合物中该化合物的质量×化合物中该元素的质量分数
5. 物质的分类知识
(1)从宏观上讲:纯净物由同种物质组成,混合物由不同种物质组成。
(2)从微观上讲:纯净物由同种分子构成,混合物由不同种分子构成。
(3)判断纯净物和混合物要从物质的种类上进行区分,同一物质不同的状态当然属于纯净物,如冰水混合物是纯净物;单质是由同种元素组成的纯净物,离开了纯净物这一范畴,单质这一概念就失去了意义;化合物是由不同种元素组成的纯净物,但要注意结晶水合物,如Na2CO3·10H2O属于化合物;氧化物是由两种元素组成,其中一种元素是氧元素的化合物,如H2O属于氧化物。
4. 化合价的应用

3. 化学式的意义
(1)表示一种物质;(2)表示组成这种物质的元素;(3)表示构成这种物质的一个分子;(4)表示这种物质的相对分子质量。
2. 构成物质的粒子
构成物质的粒子有分子、原子、离子三种,某些气体单质和某些化合物是由分子构成的,分子保持着该类物质的化学性质(不保持物理性质)。如氧气是由氧分子构成的,保持氧气化学性质的粒子是氧分子;金属、稀有气体是由原子构成的,原子保持着该类物质的化学性质。如铁是由铁原子构成的,保持铁的化学性质的最小粒子是铁原子;离子化合物(由阴、阳离子相互作用构成的化合物)是由离子构成的,阴、阳离子共同保持着该物质的化学性质。如氯化钠是由钠离子和氯离子构成的,保持其化学性质的粒子是钠离子和氯离子。
1. 分子、原子、离子、元素的概念及相互关系
分子、原子、离子、元素的概念要掌握清楚。它们的相互关系为:
(1)分子与原子的根本区别:在化学反应中分子可以再分,而原子不能再分。
(2)分子与原子的联系:分子和原子都是构成物质的基本粒子,分子是由原子构成的,分子和原子都不带电。
(3)离子是带电的原子(或原子团)。
(4)元素是一类原子的总称,只论种类不能论个数。元素的种类是由原子的核电荷数(即核内质子数)决定的。
(5)分子、原子和离子都属于微观粒子,在描述物质时应用“构成”,而不能用“组成”,元素表示的是宏观概念,在描述物质时应用“组成”。
61.答案:C。
析:这是一道推理计算题。从Family Railcard中的优惠条件和题干的意思不能得出15+3×3=24这个数字。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com