
4.

图1-4-13
在“研究匀变速直线运动”的实验中,打点计时器使用的交流电源的频率为50 Hz,记录小车运动的纸带如图1-4-13所示,在纸带上选择6个计数点A、B、C、D、E、F,相邻两计数点之间还有四个点未画出,各点到A点的距离依次是2.0 cm、5.0 cm、9.0 cm、14.0 cm、20.0 cm.
(1)根据学过的知识可以求出小车在B点的速度为vB=________ m/s.CE间的平均速度为________ m/s;
(2)以打B点时为计时起点,建立v-t坐标系如右图所示.请在图中作出小车运动的速度与时间的关系图线;
(3)根据图线可得小车运动的加速度为________ m/s2.
解析:(1)相邻两个计数点间的时间间隔为0.1 s
所以vB== m/s=0.25 m/s
CE== m/s=0.45 m/s
(2)v-t图象如右图所示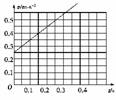
(3)在v-t图象中,图线的斜率表示加速度,即a= m/s2=1 m/s2
答案:(1)0.25 0.45 (2)图见解析 (3)1
3.

图1-4-12
某同学让重锤做自由落体运动,利用打点计时器打出的纸带来测量当地的重力加速度.该同学在实验中得到6条纸带,如图1-4-12所示为其中一条,在纸带上取6个计数点,两个相邻计数点间的时间间隔为T=0.02 s.其中1、2、3点相邻,4、5、6点相邻,在3点和4点之间还有若干个点.x1是1、3两点的距离,x3是4、6两点的距离,x2是2、5两点的距离.
(1)测x1、x2、x3后,点2速度的表达式v2=________.
(2)该同学测得的数据是x1=4.00 cm,x2=19.30 cm,x3=8.72 cm,根据数据求出重力加速度g=_______ m/s2(保留三位有效数字).
(3)测量值小于当地的重力加速度真实值的原因是_____________________________________________________________.
解析:(1)平均速度2=即为计数点2的瞬时速度.
(2)点2的速度为v2=.点5的速度为v5=.由v-v=2ax2.代入数据得a=9.72 m/s2.
(3)由于阻力作用,测量值小于真实值.
答案:(1)x1/2T (2)9.72 (3)阻力作用
2.
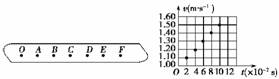
图1-4-10 图1-4-11
某同学在做“探究小车速度随时间变化的规律”的实验时,打点计时器所用电源的频率是50 Hz,在实验中得到一条点迹清晰的纸带,他把某一点记作O,再选依次相邻的6个点作为测量点,分别标以A、B、C、D、E和F,如图1-4-10所示.
(1)如果测得C、D两点相距2.70 cm,D、E两点相距2.90 cm,则在打D点时小车的速度是__________________m/s.
(2)该同学分别算出打各点时小车的速度,然后根据数据在v-t坐标系中描点(如图1-4-11所示),由此可求得小车的加速度a=________ m/s2.
解析:(1)根据匀变速直线运动的规律,打D点的速度等于CE段的平均速度,即vD== m/s=1.40 m/s. 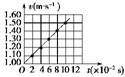
(2)根据描点作一条过原点的直线,直线的斜率即为小车的加速度.
图象如图所示,求出加速度为5.00 m/s2.
答案:(1)1.40 (2)5.00
1.
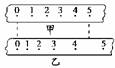
图1-4-9
如图1-4-9所示,为同一打点计时器打出的两条纸带,由纸带可知( )
A.在打下计数点“0”至“5”的过程中,纸带甲的平均速度比乙的大
B.在打下计数点“0”至“5”的过程中,纸带甲的平均速度比乙的小
C.纸带甲的加速度比乙的大
D.纸带甲的加速度比乙的小
解析:在打下计数点“0”至“5”的过程中,两纸带所用时间相同,但甲纸带位移小于乙纸带位移,故甲<乙,选项A错,B对;相邻计数点间所用时间相等,但乙的速度变化得更快,故a甲<a乙,选项C错,D对.
答案:BD
10.(2010四川理综卷)有关①100ml 0.1 mol/L 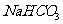 、②100ml 0.1 mol/L
、②100ml 0.1 mol/L 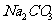 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的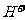 个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: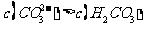 D.②溶液中:
D.②溶液中: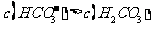
答案: C
解析:本题考查盐类水解知识;盐类水解促进水的电离,且Na2CO3的水解程度更大,碱性更强,故水中电离出的H+个数更多,A项正确;B②钠离子的物质的量浓度为0.2 mol/L而①钠离子的物质的量浓度为0.1 mol/L根据物料守恒及电荷守恒可知溶液中阴离子的物质的量浓度之和:②>①,B项正确;C项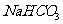 水解程度大于电离所以C(H2CO3)>C(CO32-)D项
水解程度大于电离所以C(H2CO3)>C(CO32-)D项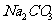 C032-分步水解第一步水解占主要地位且水解大于电离。判断D正确。C、D两项只要写出它们的水解及电离方程式即可判断。
C032-分步水解第一步水解占主要地位且水解大于电离。判断D正确。C、D两项只要写出它们的水解及电离方程式即可判断。
(2010江苏卷)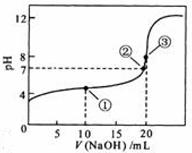 12.常温下,用 0.1000 mol·L
12.常温下,用 0.1000 mol·L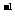 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L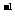
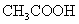 溶液所得滴定曲线如右图。下列说法正确的是
溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:
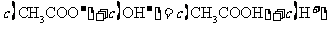
B.点②所示溶液中:
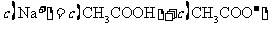
C.点③所示溶液中:
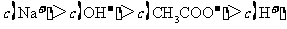
D.滴定过程中可能出现:
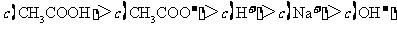
[答案]D
[解析]本题主要考查的是粒子浓度大小的比较。A项,处于点①时,酸过量,根据电荷守恒,则有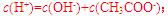 B项,在点②时,pH=7。仍没有完全反应,酸过量,
B项,在点②时,pH=7。仍没有完全反应,酸过量, ;C项。当
;C项。当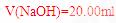 时,两者完全反应,此时由于
时,两者完全反应,此时由于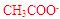 的水解,溶液呈碱性,但水解程度是微弱的,
的水解,溶液呈碱性,但水解程度是微弱的,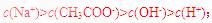 D项,在滴定过程中,当
D项,在滴定过程中,当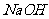 的量少时,不能完全中和醋酸,则有
的量少时,不能完全中和醋酸,则有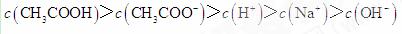 综上分析可知,本题选D项。
综上分析可知,本题选D项。
16.(2010上海卷)下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+]
B.pH=2的一元酸和pH=12的一元强碱等体积混合: [OH-]= [H+]
C.0.1 mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1 mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]
答案:C
解析:此题考查了溶液中的微粒浓度的大小比较。氨水和氯化铵混合溶液的pH=7时,溶液中[H+]=[OH-],则[Cl-]=[NH4+],A错;由于pH=2的酸的强弱未知,当其是强酸正确,当其是弱酸时,酸过量则溶液中[H+]>[OH-],B错;1mol.L-1的硫酸铵溶液中,铵根离子部分水解,根据物质的组成,可知:[NH4+]>[SO42-]>[H+],C对;1mol.L-1的硫化钠溶液中,根据物料守恒,可知[OH-]=[H+]+[HS-]+2[H2S],D错。
技巧点拨:在解答溶液中微粒浓度的大小比较类的题目时,核心是抓住守恒,其包括:电荷守恒、物料守恒和质子(氢离子)守恒。其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数;物料守恒是指原子个数守恒或质量守恒;质子守恒:是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。
14.(2010上海卷)下列判断正确的是
A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L mol·L-1硫化钠溶液吸收SO2的量
答案:C
解析:此题考查了实验操作、化学反应中的能量变化、溶液的pH、元素化合物等知识。测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,说明部分硫酸铜分解生成了氧化铜,测定值大于理论值,A错;氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1molH2,B错;碳酸的酸性弱于醋酸,故此相同浓度的碳酸钠溶液的pH大于醋酸钠溶液,C对;1L 1mol.L-1的溶液中含有溶质1mol,前者发生:Na2CO3+SO2+H2O=2NaHSO3+CO2↑;后者发生:2Na2S+5SO2+2H2O=4NaHSO3+3S↓;分析可知,很明显后者大于前者,D错。
易错警示:此题解答是的易错点有二:一是对化学键的形成断开和吸热放热的关系不清,要能够准确理解断键吸热成键放热;二是忽视亚硫酸的酸性强于氢硫酸,不能准确判断硫化钠中通入二氧化硫时要生成氢硫酸,造成氢硫酸和亚硫酸能发生氧化还原反应生成单质硫。
10.(2010福建卷)下列关于电解质溶 液的正确判断是
液的正确判断是
A.在pH = 12的溶液中,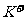 、
、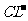 、
、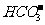 、
、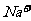 可以常量共存
可以常量共存
B.在pH=
0的溶液中,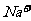 、
、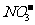 、
、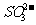 、
、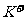 可以常量共存
可以常量共存
C.由0.1
mol·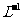 一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=
一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=
D.由0.1
mol·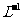 一元碱HA溶液的pH=3, 可推知NaA溶液存在A- + H2O⇋HA + OH-
一元碱HA溶液的pH=3, 可推知NaA溶液存在A- + H2O⇋HA + OH-
[解析]答案:D
本题考查常见离子的 共存、弱电解质溶液的电离和水解
共存、弱电解质溶液的电离和水解
A. pH=12的溶液呈碱性含有比较多的OH-,不能与HCO3-共存
B. pH=0的溶液呈酸性含有较多的H+,在NO3-离子存在的情况下,亚硫酸根离子容易被氧化成硫酸根离子,无法共存
C. 0.1mol/L的一元碱的pH=10表明该一元碱是弱碱,在溶液中不能完全电离
D. 由题意可得该酸是弱酸,在NaA溶液中A-会发生水解而使溶液呈碱性
12.(2010广东理综卷)HA为酸性略强与醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+ c(OH-)= c(A-)+ c(H+)
D.c(Na+)+ c(H+) = c(A-)+ c(OH-)
解析:A明显错误,因为阳离子浓度都大于阴离子浓度,电荷不守恒;D是电荷守恒,明显正确。NaA的水解是微弱的,故c(A-)>c(OH-),B错;C的等式不符合任何一个守恒关系,是错误的;
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com