
28.(10分,每空1分)
⑴ b.坩埚 c.干燥器 ① b ②冷却, c
⑵ 相邻两次称量的质量差小于0.001g; 确保晶体失去全部结晶水
⑶ ①5.6 ②偏高 ③ c
三、(本题共14分)
27.(6分,每空1分)
⑴ 电子层数,VIA
⑵ a
⑶  ,NH3
,NH3
⑷ HClO4>H2SO4(全对给1分,有错不得分)
26.(10分,每空1分)
⑴ Al(OH)3+3H+→Al3++3H2O
⑵ KAl(SO4)2·12H2O, Cl2+H2O
 HCl+HClO
HCl+HClO
⑶ ① (全对给1分,有错不得分),
(全对给1分,有错不得分),
② Fe(NO3)3
⑷ ①< ②增大 ③<
⑸ 氯气, 能使湿润的KI淀粉试纸变蓝
31.通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质。现某学习小组利用中和滴定原理测定氢氧化钠的质量分数。步骤为:
①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
 ②用4.80%(密度是1.02g/mL)的盐酸滴定。以下是实验数据记录表:
②用4.80%(密度是1.02g/mL)的盐酸滴定。以下是实验数据记录表:
|
实验序号 |
待测样品溶液体积(mL) |
滴定管读数 |
消耗标准盐酸溶液的体积(mL) |
|
|
初读数 |
末读数 |
|||
|
1 |
20.00 |
0.00 |
19.95 |
19.95 |
|
2 |
20.00 |
0.05 |
|
|
(1)请根据右图(滴定管局部)读出第2次实验的末读数,填充上表中的两个空格。
(2) 计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001)。
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数。
2010年闵行区高中结业文化考试
化学试卷评分参考
30.标准状况时,2.59g某气态烃的体积为1L, 5.8 g该烃完全燃烧产生8.96 LCO2。
⑴ 该烃的分子式是______________。
⑵ 写出该烃可能的结构简式和系统名称。
29.煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。
(1) 乙烯是石油化工最重要的基础原料,请根据以下框图回答:

①A的结构简式为__________________,C中的官能团名称是__________________。
②写出“A+C→乙酸乙酯”的化学方程式____________________________________。
③“乙烯→A”的反应类型是__________反应。下列物质在一定条件下都能与乙烯反应,其中反应类型与“乙烯→A”的不相同的是_____________(填序号)。
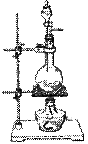 a.氢气 b.氯化氢 c.氧气 d.溴水
a.氢气 b.氯化氢 c.氧气 d.溴水
④实验室常用浓硫酸和乙醇共热制取乙烯。
若实验室用右图装置作为制取乙烯发生装置是不合适的,
理由是____________________________________________。
实验时常在烧瓶中加入沸石,目的是_______________________。
实验室常用_________________收集乙烯。
(2) 煤通过干馏后可得到焦炭、煤焦油、粗氨水和焦炉气。从煤焦油中可以分离出一种重要的液态烃--苯。
①从煤焦油中分离出苯的方法是____________(填序号)。
a.干馏 b.分馏 c.分液 d.萃取
②现代化学认为苯分子中的碳碳键是________________________________________。
③苯和液溴可以发生反应。根据下图装置回答:
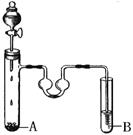
反应时A试管内须放些铁丝,铁丝的作用是__________________________,A试管中发生的反应的化学方程式为 。
双球U型管里盛放的液体是CCl4,其作用是 。
B试管是用于证明该反应是取代反应。当B试管盛放的是_____________(填序号)时可以证明反应是取代反应。
a.硝酸银溶液 b.石蕊稀溶液 c.氢氧化钠溶液
四、(本题共10分)
28.测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程如下:
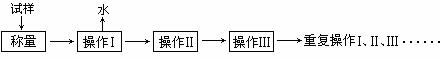
回答下列问题:
⑴ 以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称。

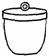

a.电子天平 b.___________ c.____________ d.酒精喷灯
①“操作I”是灼烧硫酸铜晶体,用到上述______________(填序号)仪器。
② “操作Ⅱ”的操作是_________,必须在______________(填序号)中进行。
⑵ “重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作。
判断达到恒重的依据是___________________________________________________;
进行恒重操作的目的是___________________________________________________。
⑶ 某学生实验后得到以下表数据:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水硫酸铜) |
|
5.400
g |
7.900
g |
6.900
g |
①根据以上数据计算该硫酸铜晶体中结晶水x的值为________________(精确到0.1)。
②该学生测定结果____________________(填“偏高”、“偏低”或“正确”)。
③从下列分析中选出该学生产生实验误差的原因可能是(填序号)________________。
a.没有进行恒重操作
b.加热固体到白色后,露置在空气中冷却
c.加热过程中晶体有少量溅失
d.加热后在干燥器中冷却至室温后称量
三、(本题共14分)
27. 右图是短元素周期表的一部分。
右图是短元素周期表的一部分。
⑴ 从原子结构角度分析,①、②、③三种元素的____________________相同,②、④位于元素周期表的第__________族;
⑵ 科学家通过对①-⑤元素的化合物进行研究,从而寻找__________(选填序号)。
a.高效农药 b.催化剂
c.耐高温、耐腐蚀的合金材料 d.半导体材料
⑶ 研究①-⑤元素的气态氢化物(用化学符号回答):②的气态氢化物的电子式_____________________,能使湿润的红色石蕊试纸变蓝的是_________(填化学式)。
⑷ ④和⑤的元素最高价氧化物对应水化物的酸性__________>__________(填化学式)。
26.很多化学物质在生活中扮演着重要的角色。请根据下列内容填空。
⑴ 胃舒平的主要成分是氢氧化铝,用以治疗胃酸过多,用离子方程式表示其反应原理:___________________________________________________。
⑵ 自来水生产过程中需要加入净水剂和消毒剂,传统生产过程用_____________(写化学式)作净水剂,用液氯作消毒剂,液氯可以消毒杀菌的原因为(用化学方程式表示)
。
⑶ 铁酸钠(Na2FeO4)是水处理中使用的一种新型净水剂,可以用如下反应得到。
2Fe(NO3)3 + 16NaOH + 3Cl2 → 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O
①在上述化学方程式上方,标出该反应的电子转移方向和数目。
②该反应中还原剂是_______________。
⑷ 食醋中含有醋酸。回答以下问题。
①0.01mol/L醋酸溶液中c(H+)___________0.01mol/L (填“>”、“<”或“=”)。
②将10mL0.1mol/L醋酸,加水稀释至200mL,稀释过程中溶液pH值___________(填“增大”、“减小”或“不变”)
③室温下pH均为2的盐酸和醋酸,物质的量浓度分别为c1、c2,则c1________ c2(填“>”、“<”或“=”)。
⑸ 食盐不仅是每家必备的调味品,也是重要的化工生产原料。电解饱和食盐水得到氯气、氢气和氢氧化钠。电解时在阳极上产生的气体是____________,检验该气体的最简便方法为___________________________________________________。
25.在445℃的密闭容器中,分别加入0.1mol/LH2和I2,发生反应H2+ I2(g) 2HI,定时测定反应体系中各物质的浓度,记录数据(如下表)
2HI,定时测定反应体系中各物质的浓度,记录数据(如下表)
|
时间/s 浓度 |
c(H2)/mol/L |
c(I2)/mol/L |
c(HI)/mol/L |
|
0 |
0.1 |
0.1 |
0 |
|
30 |
0.040 |
0.040 |
c 1 |
|
60 |
0.022 |
0.022 |
0.156 |
|
80 |
0.022 |
0.022 |
c 2 |
下列说法错误的是
A.30s内用H2表示的平均反应速率υ(H2)=0.002mol/(L·s)
B.c 1<0.156 mol/L,c 2=0.156 mol/L
C.在其它条件不变时,升高反应温度,气体颜色变浅,则该反应正反应为吸热
D.60s时,其它条件不变,将容器体积迅速压缩到原来的一半,则c(HI)>0.312mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com