
(三)胶体的制备方法
制备溶胶的必要条件是要使分散质粒子大小在lnm-100nm之间。由于溶胶是热力学不稳定体系,在制备过程中还要加入稳定剂(如电解质或表面活性物质)。制备方法原则上有两种,一是使固体颗粒变小的分散法,一是使分子或离子聚结成胶体的凝聚法。
常用的分散法有研磨法、胶溶法等。研磨法是把粗颗粒的固体放在胶体磨中研细,在研磨的同时要加入明胶等稳定剂。胶溶法是通过向新生成并经过洗涤的沉淀中加入适宜的电解质溶液作稳定剂,再经搅拌,使沉淀重新分散成胶体颗粒而形成溶胶,这种过程称为胶溶作用,如在新生成的Fe(OH)3沉淀中,加入少量FeCl3稀溶液可制得Fe(OH)3溶胶。
凝聚法有多种方法,应用也比分散法广泛,主要可分为化学反应法、改换溶剂法等。所有反应,如复分解、水解、氧化还原、分解等,只要能生成难溶物,都可以通过控制反应条件(如反应物浓度、溶剂、温度、pH、搅拌等)用来制备溶胶,这些被称之为化学反应法。例如:
(1)利用水解反应
教材中介绍的Fe(OH)3溶胶的制备,利用的就是FeCl3的水解反应:
FeCl3(稀溶液)+H2O Fe(OH)3(溶胶)+3HCl
Fe(OH)3(溶胶)+3HCl
如果将碱金属硅酸盐类水解,则可制得硅酸溶胶:
Na2SiO3(稀溶液)+2H20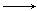 H2SiO3(溶胶)+2NaOH
H2SiO3(溶胶)+2NaOH
(2)利用复分解反应
可用稀的AgNO3溶液与稀的KI溶液的反应来制备AgI溶胶:
AgNO3(稀溶液)+KI(稀溶液)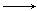 AgI(溶胶)+KNO3
AgI(溶胶)+KNO3
(3)利用分解反应
把四羰基镍溶在苯中加热可得镍溶胶:
Ni(CO)4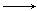 Ni(溶胶)+4CO
Ni(溶胶)+4CO
(4)利用氧化还原反应
把氧气通入H2S水溶液中,H2S被氧化,得硫磺溶胶:
2H2S(水溶液)+O2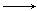 2S(溶胶)+2H2O
2S(溶胶)+2H2O
关于改换溶剂法则是利用一种物质在不同溶剂中溶解度相差悬殊的性质来制备溶胶,如把松香的酒精溶液滴入水中,由于松香在水中溶解度很低,溶质以胶粒大小析出,即形成松香的水溶胶。
无论采用哪种方法,制得的溶胶常含有很多电解质或其他杂质,除了与胶粒表面吸附的离子维持平衡的适量电解质具有稳定胶体的作用外,过量的电解质反而会影响溶胶的稳定性。因此,制备好的溶胶常常需要作净化处理,最常用的净化方法就是渗析。
例题精讲
例1下列物质中既属于无机物,又属于碱的是( )
A.Na2CO3 B.CH3OH C.CH3CH2OH D.Cu(OH)2
解析:Na2CO3是无机物,但属于盐;CH3OH和CH3CH2OH为有机物;Cu(OH)2为碱且为无机物,故答案应选D。
答案:D
例2用特殊方法把固体物质加工到纳米级(1nm-100nm)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子的大小和这种纳米粒子大小具有相同的数量级的是( )
A.溶液 B.悬浊液 C.胶体 D.乳浊液
解析:1nm-100nm就是胶体分散系中粒子的大小,跟这种超细粉末粒子大小具有相同数量级。
答案:C
例3 用下列方法来制备溶胶:①0.5mol/L BaCl2溶液和等体积的2mol/L H2SO4相混合并振荡;②把1mL饱和三氯化铁逐滴加入20mL沸水中,边加边振荡;③把1mol/L水玻璃加入10mL 1mol/L盐酸中,用力振荡。可行的是( )
A、只有①② B、只有①③ C、只有②③ D、①②③
解析:①操作,能生成BaSO4沉淀,并得不到胶体。②③是可行的。故应选(C)
例4 已知AgI胶体微粒能吸附I-离子。在10mL 0.01mol/L KI溶液中,滴入8-10(1滴是1/20mL)0.01mol/L AgNO3溶液后,将溶液装入半透膜袋中,并浸没在蒸馏滴水里。隔一段时间后,水中含有的离子最多的是( )
A、H+、OH- B、K+、NO3- C、I- D、Ag+、NO3- E、K+
解析:制备AgI胶体的原理是:KI+AgNO3=AgI(胶体)+KNO3在制备过程中KI过量,由于AgI胶体微粒能吸附I-,故在溶液中含有较多离子的是K+、NO3 -。故应选(B)。
例5、下列说法中正确的是( )
A、胶体区别于其它分散系的本质特性是丁达尔现象
B、利用半透膜可除去淀粉溶液中的少量NaCl
C、Fe(OH)3胶体带正电荷
D、加入电解质,胶体能发生凝聚
分析:本题主要考查的是胶体的概念及其对性质的理解与应用能力。胶体区别于其它分散系的本质特性是分散质微粒的直径大小,胶粒的直径在1nm-100nm之间而溶液中的溶质分子或离子直径小于1nm。因此当入射光线通过胶体时,光会发生散射,这时胶粒本身好象一个光源,而产生丁达尔现象。当入射光通过溶液时,光发生透射,不产生丁达尔现象。同样由于胶粒直径较大,它不能透过半透膜,而溶液中的离子或分子能透过半透膜。因此可用渗析的方法来提纯淀粉胶体。同溶液一样,胶体也是电中性的,因此,只能说Fe(OH)3胶粒带电荷,不能说Fe(OH)3胶体带电荷;根据分散剂状态不同,胶体可分为气溶胶、液溶胶、固溶胶三种,加入电解质只能使溶胶凝聚,其他溶胶则不能。因此在所列叙述中只有B是正确的。
答:B
例6、分别向Fe(OH)3胶体溶液中逐滴加入下列各种液体,将发生什么现象?为什么会发生这些现象?
(1)蒸馏水 (2)0.5mol/L MgSO4溶液 (3)0.5mol/L H2SO4溶液 (4)蔗糖水溶液
分析:解答这类问题,既要考虑胶体特性,又要顾及加入试剂的某些性质。例如对于向Fe(OH)3胶体溶液中加入硫酸镁溶液出现红褐色沉淀,有些同学片面理解为Fe(OH)3与MgSO4发生了复分解反应,生成了难溶的Mg(OH)2沉淀。这是对Fe(OH)3胶体特征不理解的结果。事实上Mg(OH)2的溶解度比Fe(OH)3大,因此Fe(OH)3与MgSO4之间不可能发生复分解反应;再说,Mg(OH)2是白色沉淀。而向Fe(OH)3胶体溶液中加入MgSO4溶液,出现的是红褐色沉淀。正确的解释是Fe(OH)3胶粒带正电荷,MgSO4溶液是电解质溶液,溶液中SO42-带负电荷,它与胶粒发生电性中和,使胶体凝聚,从而出现Fe(OH)3沉淀。
解答这类问题,还要正确全面地分析可能出现的实验现象,不胡乱瞎猜。如Fe(OH)3胶体溶液中逐滴加入0.5mol/L H2SO4溶液,有些同学只说成依然为澄清溶液,或者只认为产生红褐色沉淀。显然这些结论是片面的错误的。前者同学只考虑到H2SO4能与Fe(OH)3反应而未考虑H2SO4是电解质,它能中和胶粒由于吸附离子而产生的电性,使胶体发生凝聚;而后者同学只考虑胶体发生凝聚的一方面,而未考虑到随着H2SO4溶液的滴入。溶液中H+浓度随之逐渐增大,产生的Fe(OH)3沉淀又会溶解。
解:(1)向Fe(OH)3溶胶中逐滴加入蒸馏水,因水不会与Fe(OH)3反应,所以无明显现象发生,也不会影响胶体的稳定性。
(2)由于MgSO4是电解质,所以在Fe(OH)3胶体中加入MgSO4溶液后,使Fe(OH)3胶粒凝聚生成红褐色Fe(OH)3沉淀。
(3)H2SO4是电解质,当向Fe(OH)3胶体中逐滴加入H2SO4时,先使Fe(OH)3胶粒凝聚生成红褐色Fe(OH)3沉淀,但继续加入H2SO4溶液,溶液酸性增强。H2SO4与Fe(OH)3沉淀反应,使Fe(OH)3溶解。
2 Fe(OH)3+3 H2SO4= Fe2(SO4)3+6H2O
(4)蔗糖是非电解质,所以在Fe(OH)3胶体中加入蔗糖溶液无现象发生。
4.实战演练
1、胶体的本质特征:分散质粒子大小在1nm-100nm之间
2、胶体的制备与提纯:
实验室制备胶体的方法一般用凝聚法,利用盐类的水解或酸、碱、盐之间的复分解反应来制备。例如Fe(OH)3、Al(OH)3胶体就是利用盐类的水解方法来制得。
利用胶体中的杂质离子或分子能穿透半透膜,而胶体微粒不能透过半透膜的特点,可用渗析法来提纯、精制胶体。
3、胶体的分类:
 分散剂是液体--液溶胶。如Al(OH)3胶体,蛋白质胶体
分散剂是液体--液溶胶。如Al(OH)3胶体,蛋白质胶体
(1)按分散剂的状态分 分散剂是气体--气溶胶。如雾、云、烟
分散剂是固体--固溶胶。如烟水晶、有色玻璃。
(2)按分散质的粒子分 粒子胶体--胶粒是许多“分子”的集合体。如Fe(OH)3胶体。
分子胶体--胶粒是高分子。如淀粉溶胶,蛋白质胶体等。
4、胶体的性质与应用:
(1)从胶体微粒大小,认识胶体的某些特征。由于胶体微粒在1nm-100nm之间,它对光有一定的散射作用,因而胶体有特定的光学性质--丁达尔现象;也正是由于胶粒直径不大,所以胶体也有它的力学性质--布朗运动;胶体粒子较小,其表面积较大,具有强大的吸附作用,它选择吸附了某种离子,带有电荷,互相排斥,因而胶体具有相对稳定性,且显示胶体的电学性质--电泳现象。
(2)根据胶体的性质,理解胶体发生凝聚的几种方法。正是由于胶体微粒带有同种电荷,当加入电解质或带相反电荷的胶粒时,胶体会发生凝聚;加热胶体,胶粒吸附的离子受到影响,胶体也会凝聚。如果胶粒和分散剂一起凝聚成不流动的冻状物,这便是凝胶。
(3)利用胶体的性质和胶体的凝聚,可区别溶液和胶体。
1)胶体有丁达尔现象,而溶液则无这种现象。
2)加入与分散质不发生化学反应的电解质,溶液无明显现象,而胶体会产生凝聚。
40.现代人把地球说成“地球村”,它突出体现的世界经济发展的特点是: ( )
A.世界大同 B.知识经济 C.经济全球化 D.经济区域集团化
第II卷(非选择题 共60分)
39.当今对世界经济影响最大的三大区域集团是: ( )
①欧洲联盟 ②北美自由贸易区 ③亚太经济合作组织
④世界贸易组织 ⑤东盟
A.①②④ B.②③④ C.①②③ D.②③⑤
38.小王计划利用今年假期去法德等欧洲大陆国家旅游。为了旅游方便,建议他去银行兑换的货币最好是: ( )
A.英镑 B.法郎 C.美元 D.欧元
37.第二次世界大战后,世界上出现的第一个以法律形式调整国际贸易和贸易关系的规则和程序,建立起缔约方之间权利和义务关系的体制的是: ( )
A.《布雷顿森林协定》 B.关贸总协定
C.世界银行 D.国际货币基金组织
36.国际货币金融体系中决定缔约方投票权多少的是: ( )
A.平均分配 B.以认缴股金的分量为依据
C.黄金贮备量 D.在联合国中的地位
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com