
4.若 ,则下列不等式:
中正确的是 ( )
A.(1)(2) B.(2)(3) C.(1)(3) D.(3)(4)
3.设等差数列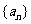 的前
的前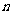 项和为
项和为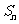 ,若
,若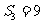 ,
,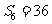 ,则
,则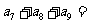 ( )
( )
A.63 B.45 C.36 D.27
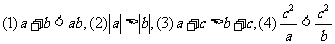

2.已知sin( )=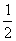 ,则cos(
,则cos( )的值为 ( )
)的值为 ( )
A.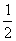 B.-
B.-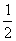 C.
C.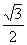 D.-
D.-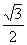
1.不等式 的解集是 ( )
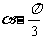 A.
A.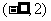 B.
B. C.
C.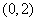 D.
D.

26.(16分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应只生成CuSO3一种沉淀;
乙同学认为这两溶液能相互促进水解,生成气体和Cu(OH)2一种沉淀;
丙同学认为同时生成CuCO3和Cu(OH)2两种沉淀。(已知:CuCO3和Cu(OH)2均不带结晶水)
I(1)写出Na2CO3溶液水解的离子方程式 ;
(2)在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为: (填操作名称)、干燥。
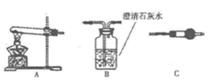 Ⅱ.请用右图所示装髓,选择必要的试剂,进行定性探究生成物的成分。
Ⅱ.请用右图所示装髓,选择必要的试剂,进行定性探究生成物的成分。
(1)各装置连接顺序为 → →
→ 。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列装置的连接,进行定量分析来测定其组成。
(1)装置c中碱石灰的作用是
(2)实验开始时和实验结束时都要通人处理过的过量空气,其作用分别是:
。
(3)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3岛的质量分数为 ×100%。
25.(18分)A、B、C三种强电解质,它们在水中电离出的离子如右表所示:
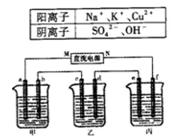 右图所示装置中,甲、乙、丙三个烧杯依次分别盛
右图所示装置中,甲、乙、丙三个烧杯依次分别盛
放足量的A溶液、足量的B溶液、足量的C溶液,电
极均为石墨电极。接通电源,经过一段时间后,测得乙
中c电极质量增加了16 g。常温下各烧杯中溶液的pH
与电解时间t的关系如右下图。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)
电极b上发生的电极反应为 ;
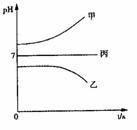 (2)计算电极e上生成的气体在标准状态下的体
(2)计算电极e上生成的气体在标准状态下的体
积: ;
(3)写出乙烧杯的电解池反应 ;
(4)如果电解过程中B溶液中的金属离子全部析出,此时
电解能否继续进行,为什么? ;
(5)若经过一段时间后,测得乙中c电极质量增加了16 g,
要使丙恢复到原来状态的操作 。
24. (4分)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32一(aq) BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(4分)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32一(aq) BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(1)现有0.20 mol BaSO4,每次用1.00 L 2.0 mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理 次。
(2)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是 。
23.(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
 反应I:CO(g)+2H2(g) CH3OH(g) △H1
反应I:CO(g)+2H2(g) CH3OH(g) △H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
|
温度 |
25℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H1 0(填“>”、
“=”或“<”)。
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
22. (10分)800K时将1mo A(g)和l molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+B(g) c(g)+D(g),在某条件下达到平衡时有2/3的A转化为D,求:
(10分)800K时将1mo A(g)和l molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+B(g) c(g)+D(g),在某条件下达到平衡时有2/3的A转化为D,求:
(1)该平衡混合物中D的体积分数;
(2)该温度下的平衡常数;
(3)B的转化率。
B卷(满分50分)
21.(12分)某研究性学习小组为了研究醋酸的电离情况,进行了如下探究。
实验一 配制并标定醋酸溶液的浓度
用冰醋酸配制250 mol·L-1的醋酸溶液,再用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液。
(1)配制此醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为了标定所配制醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.04 |
20.00 |
18.80 |
19.96 |
则该醋酸溶液的准确浓度为 。(保留四位有效数字)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
|
醋酸浓度(mol·L-1) |
0.001 |
0.01 |
0.02 |
0.1 |
0.2 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(4)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度将 。(填增大、减小或不变)
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验方案完成该实验,简述实验的方案: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com