
4、NO2、NO、O2的混合气体与水反应
关系式: V(O2)= V(NO2)/4+ 3V(NO)/4
特例,当V(NO): V(NO2)::V(O2)=1:1:1时,混合气体全部与水反应,无气体剩余。
例4.常温下盛有10mlNO2和10mlNO组成的混合气体的大试管倒立于水中,当缓缓通入O2一段时间后,试管内残留2ml气体,则通入O2体积可能为多少毫升
解析:残留2ml气体可能是NO也有可能是O2,应予以讨论
(1)若残留气体是NO ,则转化为HNO3的NO为10ml-2ml=8ml
则:4NO2+O2+H2O=4HNO3
4 1
10ml y
4 /10ml =1/ y 解得:y=2.5ml
4NO+3O2+H2O=4HNO3
4 3
8ml x
4/8ml =3/ x 解得:x=6ml
共耗氧气V(O2)=2.5ml+6ml=8.5ml
(2)若残留气体2ml是O2,则:
4NO+3O2+H2O=4HNO3
4 3
10ml z
4/10ml =3/ z 解和z=7.5ml
故通入 V(O2)=2.5+7.5+2=12ml
答:(略)
例5.(2001春季北京、内蒙、安徽高考)关于非金属N、O、Cl、P的叙述,正确的是( )
A.在通常情况下其单质均为气体
B. 其单质均由双原子分子组成
C. 都属于主族元素
D.每种元素公生成一种氢化物
解析:N、O、Cl通常情况下单质为气体,且为双原子分子,而P不是,白磷为P4分子,其中N的氢化物有NH3、N2H4等,O的氧化物有H2O、H2O2,所以A、B、D选项均不正确。正确答案为C。
例6.氮气与其他单质化合一般需要高温,有时还需高压等条件,但金属锂在常温、常压下就能与氮气化合生成氮化锂,这是因为( )
①此反应可能是吸热反应
②此反应可能是放热反应
③此反应可能是氮分子不必先分解成为原子④此反应前可能氮分子先分解成为原子
A.①② B.②④ C.②③ D.①④
解析:氮分子中存在N≡N,键能很大,非常
牢固,通常情况下很难断裂N≡N键成为氮原子与其他物质反应,如果氮分子能与这种物质容易反应,只可能是氮分子不必先分解为氮原子这种情况;另外化学反应中放热反应一般比较容易发生。综上所述正确选项应为C选项。
例7.(2002年南京市模拟题)工业废气的氮
氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一。为了保护环境,工业上常通入氨气与之发生如下反应:
 NOx+NH3 N2+H2O
NOx+NH3 N2+H2O
有关此反应,下列说法中错误的是( )
A.N2既是氧化产物又是还原产物
B. 当x=1时,每生成2.5mol N2,被氧化的
气体有3mol
C.当x=2时,有1mol气体被还原,转移电子4mol
D.反应通式配平表示为:
6 NOx +4x NH3 = (3+2x)N2+6x H2O
解析:分析平配平方程式得到A、D选项均正确,将x=1代入6 NOx +4x NH3 = (3+2x)N2+6x H2O中得到6NO+4NH3=5 N2+6H2O 分析可知:每生成5mol,被氧化的气体有4mol(被氧化的气体为NH3),则每生成2.5mol N2,被氧化的气体只有2mol。同理可推得C选项正确。所以,答案应为选项B。
例8.(1994·全国·17)已知磷酸分子
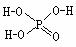
( )中的三个氢原子都可以跟重
水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可以跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换。由此可推断H3PO2的分子结构是( )
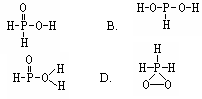
A.
C.
解析:题中所给磷酸分子的结构式是给的一个信息:含氧酸中只有与O原子直接结合的H原子才可能电离出H+,即题中所说的与D2O中的D原子发生氢交换。把信息迁移到H3PO2中,由于NaH2PO2不能与D2O进行氢交换,所以H3PO2只是一元酸,因而其结构式中只有一个-OH,再应用O原子只能有两个共价键的基础知识,就不难推出正确选项为B。
3、NO与O2分别通入水中
关系式:4NO+3O2+H2O=4HNO3
讨论如下:
|
NO与O2的体积比 |
发生的化学反应 |
剩余气体 |
|
=4:3 |
4NO+3O2+H2O=4HNO3 |
无 |
|
<4:3 |
4NO+3O2+H2O=4HNO3 |
O2 |
|
>4:3 |
4NO+3O2+H2O=4HNO3 |
NO |
例3.一定条件下,将等体积的NO和O2混合于一试管中,然后将试管倒立于盛有水的水槽中,充分反应后剩余气体的体积与原混合气体的体积之比是多少?
解析: 因为混合气体中NO和O2的体积比<4:3,则剩余气体为O2
设混合气体中NO 的体积为x,则O2的体积也为x
4NO+3O2+H2O=4HNO3
4 3
x y
4/ x =3 / y 解得:y=3x/4
剩余的O2为x-3x/4=x/4
它与原混合气体的体积比为x/4:2x=1:8
2、NO2和O2 的混合气体与水的反应
关系式:4NO2+O2+H2O=4HNO3
将(2)×2-(1)得到,目的:消去中间产物NO)
讨论如下:
|
NO2与O2的体积比 |
发生的化学反应 |
剩余气体 |
|
=4:1 |
4NO2+O2+H2O=4HNO3 |
无 |
|
<4:1 |
4NO2+O2+H2O=4HNO3 |
O2 |
|
>4:1 |
4NO2+O2+H2O=4HNO3 3NO2+H2O=2H2NO3+NO |
NO |
例2.将充满NO2和O2的混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量筒体积的一半处停止了,则原混合气体中NO2和O2的体积比是多少?
解析:NO2和O2的体积比不等于4:1,则需讨论NO2和O2分别过量时的两种情况
设混合气体的体积为1,混合气体中NO2的体积为x,则O2为(1- x)
(1)假定原混合气体中V(NO2):(O2)<4:1
4NO2+O2+H2O=4HNO3
4 1
x y
4/x=1/y 解得y=x/4
剩余的O2:(1-x)-x/4=1/2 解得x=2/5
V(NO2):V(O2)=2/5:(1-2/5)=2:3
(2) 假定原混合气体中V(NO2):V(O2)>4:1
4NO2+O2+H2O=4HNO3
4 1
y (1-x)
4/ y =1/(1-x) 解得:y=4(1-x)
暂时剩余NO2:1-[4(1-x)+(1-x)]=5x-4
由反应式:3NO2+H2O=2H2NO3+NO可知
最后剩余NO :(5x-4)/3
由(5x-4)/3=1/2得 x=11/10(不合题意,舍去)
小结: NO2和O2的混合气体与水反应时,当剩余气体的体积大于原混合气体体积的1/3时,只有一个条件:V(NO2):V(O2)>4:1(此结论由同学们自行证明)
1、NO(N2)、NO2混合气体与水反应
例1. 将20ml充满NO和NO2的混合气体的试管倒立于盛水的水槽中,充分反应后,剩余气体的体积变为10ml,求原混合气体中NO和NO2 各占多少毫升?
解析:NO不与水反应,NO2与水反应时每一体积的NO2会生成1/3体积的NO ,所以剩余的气体为未参加反应的NO 和生成的NO
解法一:设原混合气体中含NO2 xml ,
则含NO(20-x)ml
3NO2+H2O=2H2NO3+NO
3 1
x y
3/x=1/y解之得:y=x/3
由题意得:(20-x)+x/3=10 解得x=15ml
则原NO的体积 20-15=5ml
答:(略)
解法二: (差量法)设原混合气体中含NO2气体xml
3NO2+H2O=2H2NO3+NO △V
3 (3-1)
x (20-10)
3/x=(3-1)/(20-10) 解得 x=15ml
答:(略)
3.例题精讲
有关NO、NO2、O2的混合气体和水反应的计算
基本反应 : 2NO+O2=2NO2------------------(1)
3NO2+H2O=2H2NO3+NO------(2)
3.磷酸与碱反应的规律:
 =1∶1时生成NaH2PO4
=1∶1时生成NaH2PO4
=1∶2时生成Na2HPO4
=1∶3时生成Na3PO4
介于1∶1和1∶2之间,则生成
NaH2PO4和Na2HPO4的混合物
介于1∶2和1∶3之间,则生成Na2HPO4和Na3PO4的混合物。
2.在氮族元素中氮和其它元素比较,有很大的特殊性,它的主要化合价有-3、+1、+2、+3、+4、+5等多种氮元素能以不同的价态与氧结合,可以形成多种氧化物:N2O、NO、N2O3、N2O4、NO2、N2O5。在这些氧化物中NO2和N2O4可以通过非氧化还原反应相互转化:2NO2 N2O4。
有关氮的氧化物知识应注意:
①NO是一种无色无味气体,能与人血液中的血红蛋白结合而使人中毒。接触空气后立即被氧化为NO2而变红棕色,收集NO气体必须用排水集气法。实验室中制NO气体是铜与硝酸反应:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
NO在神经信号传递、血压生理调控、血流量控制、免疫调节、抵抗感染等方面起到了重要作用,被称为“明星分子”或“信使分子”(2004年高考理综27小题)。
②NO2是一种红棕色、具有剌激性气味、有毒的气体。它与水反应,而易溶于水:
3NO2+2H2O=2HNO3+NO↑
在反应中NO2既是氧化剂又是还原剂。
在NO2中,因N的价态较高,它的氧化性较强,NO2能氧化SO2、KI等物质:
NO2+SO2=SO3+H2O
 NO2+2KI=2KNO2+I2(NO2能使湿润的淀粉KI试纸为蓝)
NO2+2KI=2KNO2+I2(NO2能使湿润的淀粉KI试纸为蓝)
③ 隐含反应2NO2 N2O4的应用:
在实验测定NO2、N2O4的相对分子质量、比较相同条件下相同物质的量的气体体积大小,以及涉及到NO2气体的颜色深浅、压强、密度等方面时要考虑此反应。
1.氮族元素最外层电子都是5个,主要显+5、+3、-3价。本族元素形成的+3、-3价化合物中其原子已达到稳定结构,如NH3、PCl3、BiCl3、Mg3N2。
2.原理、规律、疑难剖析:
4.磷及其化合物的性质
(1)磷单质的化学性质和用途
 4P+5O2 2P2O5
4P+5O2 2P2O5
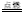 2P+3Cl2 2PCl3(l)
2P+3Cl2 2PCl3(l)
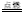 2P+3Cl2 2PCl5(s)
2P+3Cl2 2PCl5(s)
用途:制高纯度磷酸、红磷用于制农药、安全火柴、白磷制造燃烧弹和烟幕弹。
(2)磷的化合物
①P2O5:极易溶于水,是较好的干燥剂(吸湿性很强)能与水作用:
P2O5+H2O(冷)=2HPO3(剧毒)
P2O5+3H2O(热)=2H3PO4(无毒)
②H3PO4:无色晶体,与水任意比例互溶,有吸湿性,可作干燥剂,属非氧化性酸,沸点高。
化学性质:具有酸的通性,是三元中强酸,是一种高沸点酸。能与碱中和、与NaBr、NaI作用。
③磷酸盐:
溶解性:磷酸二氢盐均易溶于水,溶液呈酸性;磷酸盐和磷酸一氢盐除钾、钠、铵盐外不溶于水。
相互转化:
磷酸盐 磷酸一氢盐 磷酸二氢盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com