
(1)已知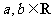 ,那么“
,那么“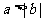 ”是“
”是“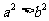 ”的
”的
(A)充分非必要条件 (B)必要非充分条件
(C)充分必要条件 (D)既非充分又非必要条件
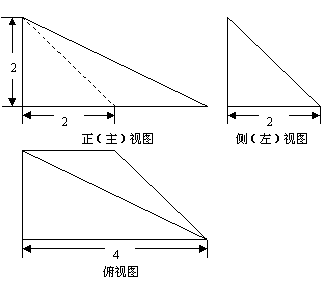 (2)一个几何体的三视图如图所示,则这个几何体的体积等于
(2)一个几何体的三视图如图所示,则这个几何体的体积等于
(A)  (B)
(B) 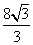 (C)
(C)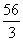 (D)
(D)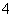
(3)设函数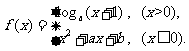 若
若 ,
,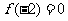 ,则
,则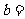
(A) 0
(B)  (C)1 (D)2
(C)1 (D)2
(4)把函数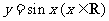 的图象上所有的点向左平移
的图象上所有的点向左平移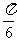 个单位长度,再把所得图象上所有点的横坐标伸长到原来的2倍(纵坐标不变),得到的图象所表示的函数为
个单位长度,再把所得图象上所有点的横坐标伸长到原来的2倍(纵坐标不变),得到的图象所表示的函数为
(A)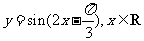 (B)
(B)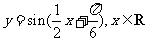
(C)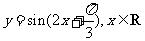 (D)
(D)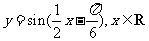
(5)已知椭圆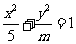 的离心率
的离心率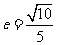 ,则
,则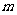 的值为
的值为
(A)3 (B)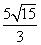 或
或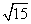 (C)
(C)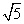 (D)
(D)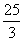 或3
或3
(6)将石子摆成如图的梯形形状.称数列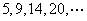 为“梯形数”.根据图形的构成,数列的第10项
为“梯形数”.根据图形的构成,数列的第10项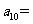



(A)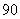 (B)
(B)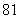 (C)
(C)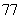 (D)
(D)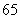
(7)已知命题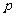 :对
:对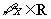 ,
,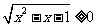 恒成立.命题
恒成立.命题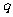 :
: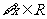 ,使
,使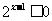 成立.
成立.
则下列命题中为真命题的是
(A)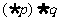 (B)
(B) (C)
(C) (D)
(D)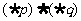
(8)设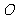 为坐标原点,
为坐标原点,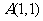 ,若点
,若点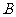 满足
满足 ,则
,则 的最小值为
的最小值为
(A)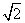 (B)2 (C)3 (D)
(B)2 (C)3 (D)
崇文区2009-2010学年度第二学期统一练习(二)
高三数学(文科) 2010.5
第Ⅱ卷(共110分)
29.(9分)已知:
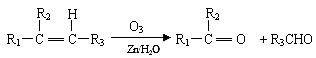 ①
①
②一个碳原子形成两个碳碳双键的结构(即C==C==C)不稳定。
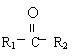
③ 与新制Cu(OH) 2不反应(以上R1、R2、R3为烃基)
某研究人员发现一个破裂的小瓶中渗漏出一未知有机物A,有催泪作用。经分析A的相对分子质量为161,该化合物中除含有C、H元素外还含有溴元素,且分子中只含有一个甲基。化合物A~F的转化关系如下图所示,其中1molC与新制的Cu(OH) 2反应只生成1molCu2O,B1和B2都是较稳定的化合物且互为同分异构体,F是六元环酯。请回答下列问题:
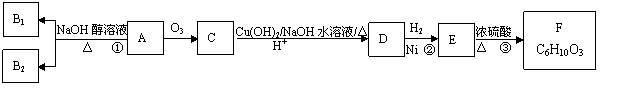

(1)①、②、③的反应类型分别是 、 、 。
(2)写出D的分子式 。
(3)写出F的结构简式 。
(4)写出由A生成B1或B2的化学方程式: 。
(5)写出满足下列条件的可能的有机物的结构简式:①该有机物分子比一个有机物C分子少4个氢原子,其余原子种类和数目与有机物C相同;②遇FeCl3溶液呈紫色;③该物质有三种类型的氢原子。其可能的结构简式是 。
(1)消去反应、加成反应(还原反应)、酯化反应(每空1分,共3分)(2)C6H10O4 (1分)

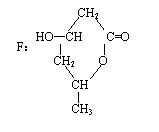 (3)
(1分)(4)(2分)
(3)
(1分)(4)(2分)
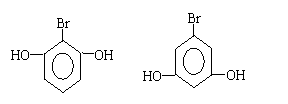
(5)(每空1分,共2分)
28、(1)CuO+CH3CH2OH CH3CHO+Cu+H2O;CH3CHO +
2[Ag(NH3)2]+ + 2OH-
CH3CHO+Cu+H2O;CH3CHO +
2[Ag(NH3)2]+ + 2OH- CH3COO- + NH4+ + 2Ag↓+ 3NH3 + H2O;防倒吸(各1分)
CH3COO- + NH4+ + 2Ag↓+ 3NH3 + H2O;防倒吸(各1分)
(2)浓氨水 AgNO3 3CuO+2NH3 N2+3Cu+3H2O 吸收浓氨水中的水分,使氨气逸出(各1分);
N2+3Cu+3H2O 吸收浓氨水中的水分,使氨气逸出(各1分);
(3)液体分层,上层是透明的油状液体,并可闻到香味 乙醇 c(各1分)
28、(12分)按下图所示装置进行有关实验,将A逐滴加入B中:
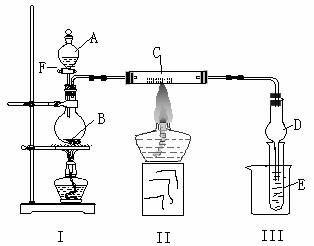
(1)若A是实验室的一种常用燃料,B是生石灰,实验中观察到C中黑色固体逐渐变红。当C中黑色固体大部分变红时关闭F,然后往烧杯中加入热水,静止一会,观察到Ⅲ中试管壁出现了光亮的银镜。请写出反应管C中所发生反应的化学方程式 。试管E中发生反应的离子方程式为 。仪器D在此实验中的作用是 。
(2)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用上图中的装置可以实现该反应。若I处酒精灯不加热,B、C仍是实验(1)中原物质,E中是某物质与葡萄糖的混合溶液。实验中也观察到C中黑色固体逐渐变红,同时可观察到E中溶液先形成沉淀,然后沉淀溶解,并有一种无色无味的气体逸出。当溶液恰好澄清时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁也出现了光亮的银镜。则A是 ,E中是 (写化学式)与葡萄糖的混合液。请写出反应管C中所发生反应的方程式 ,B的作用是 。
(3)若I处酒精灯加热,并撤去装置Ⅱ:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
某课外小组设计用该装置制取乙酸乙酯。A为浓硫酸,B为乙醇、无水醋酸钠,E中盛饱和碳酸钠溶液。已知:无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物的沸点如右表所示。则反应后E中的现象是 。从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;再加入(填字母标号) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
a.五氧化二磷 b.碱石灰 c.无水硫酸钠 d.生石灰
3.(Ⅱ) (1)5(2分);(2)2.0<x<3.0(2分);(3)1.5<x<2.0(3分)
27、(Ⅰ) (1)增大压强 t2-t3(各1分);(2) ad(3分);(3)N2+6H++6e-=2NH3(1分);(4)30%(2分)
27、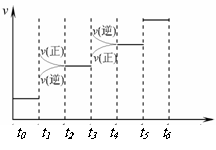 (14分)(Ⅰ)合成氨工业对国民经济和社会发展具有重要的意义,请回答下列问题:
(14分)(Ⅰ)合成氨工业对国民经济和社会发展具有重要的意义,请回答下列问题:
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是 。其中表示平衡混合物中NH3的含量最高的一段时间是 。
(2)对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如右图所示。下列叙述正确的是
。
2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如右图所示。下列叙述正确的是
。
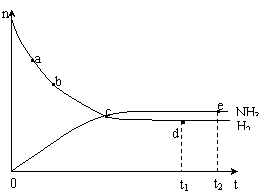 a.点a的正反应速率比点b的大
a.点a的正反应速率比点b的大
b.点c处反应达到平衡
c.点d (t1时刻) 和点e (t2时刻)处n(N2)不一样
 d.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
d.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
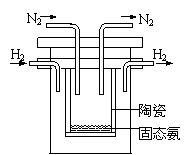
(3)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式为 。
(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,则此时H2的转化率为 。
(Ⅱ)在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写下列空白:


(1)达到平衡后,反应器左室气体总的物质的量为 mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围 。
(3)若要使右室反应开始时V正<V逆,x的取值范围 。
26、(4分)
已知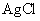 为难溶于水和酸的白色固体,
为难溶于水和酸的白色固体,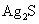 为难溶于水和酸是黑色固体。向
为难溶于水和酸是黑色固体。向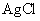 和水的悬浊液中加入足量的
和水的悬浊液中加入足量的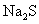 溶液并振荡,结果白色固体完全转化为黑色固体:
溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化黑色固体的化学方程式: ;
(2)白色固体转化成黑色固体的原因是: 。
25、(1)H-O-O-H 极性 三角锥型 CO(NH2)2
(2)向该溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色(其它合理答案也给分)
(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 6Fe2++3ClO2-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+
4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
(4)2FeS2+10HNO3=Fe2(SO4)3+H2SO4+10NO↑+4H2O;(5)106.7
25、(14分)物质之间的转化关系如下图所示,A是黄色固体,可作为工业生产J的原料,B、C、H、I为非金属单质。常温下,D、X均为液态化合物,且X有强氧化性,能发生自身氧化还原。F为常见的红棕色防锈油漆颜料的主要成分,O是常见含氮量最高的氮肥,A、E、J、N中含有同一种元素。部分反应的部分反应物或产物未标出。请回答下列问题:
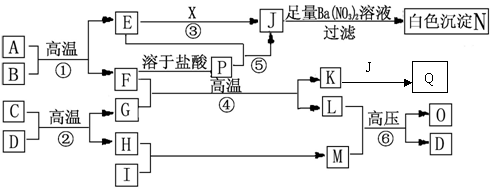

(1)X的结构式为 ,分子属于 (填“极性”或“非极性”);M分子的空间构型为 ,O的结构简式为 。
(2)实验室检验Q中阳离子的方法是 。
(3)写出下列反应的离子方程式:⑤: ;
Q的溶液中加入NaClO溶液: ;
等物质的量的Q与Na2O2反应: ;
(4)A与足量的稀硝酸反应,A中各元素均被氧化成最高价态,写出该反应的化学方程式: 。
(5)在化工生产中,由A制J,现有100T质量分数为80℅的A参加反应,若几步反应总的转化率为80℅,则可生成98℅的J溶液 T(结果保留一位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com