
26、水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是 ( )
A.1L水蒸气冷凝后与足量金属钠反应,测量产生氢气的体积
B.1L水 蒸气通过浓硫酸后,测浓硫酸增重的质量
蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的PH
D.该水蒸气冷凝后,测氢氧原子比
25、元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一 电子亲和能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能。下表中给出了几种元素或离子的电子亲和能数据:
电子亲和能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能。下表中给出了几种元素或离子的电子亲和能数据:
|
元素 |
Li |
Na |
K |
O |
O- |
F |
|
电子亲和能/kJ·mol-1 |
59.8 |
52.7 |
48.4 |
141 |
-780 |
327.9 |
下列说法正确的是 ( )
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量
C.氧元素的第二电子亲和能是-780 kJ·mol-1
D.基态的气态氧原子得到两个电子成为O2- 需要吸收能量
24、关于CS2、SO2、NH3三种物质的说法中正确的是 ( )
A.CS2在水中的溶解度很小,是由于其分子属于非极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,所以在三种物质中熔沸点最低
D.NH3在水中的溶解度很大只是由于NH3是极性分子
23、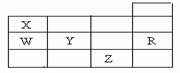 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
A.常压下五种元素的单质中, Z单质的沸点最高
Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
22、下列过程与配合物的形成无关的是 ( )
A.向一定量的硝酸银溶液中加入氨水至过量
B.除去铁粉中的氧化铝可用强碱溶液
C.向一定量的硫酸铜溶液中加入氨水至沉淀消失
D.向Fe3+溶液中加入KSCN溶液后溶液呈血红色
21、下列说法中不正确的是 ( )
A.HCl、HBr、HI的熔点沸点升高与范德华力大小有关
B.NH3的熔点沸点大于PH3的是由于NH3分子之间存在 氢键
氢键
C.甲烷和水分子之间可以形成氢键
D.乙醇与水互溶可以用相似相溶原理解释
20、NA表示阿伏加德罗常数的值,下列说法中正确的是
 ( )
( )
A.0.5mol/LNa2CO3溶液中含有的CO32-离子数目小于0.5 NA
B.0.5mol氖气含有的原子数为NA
C.常温常压下,11.2L氧气含有的分子数为0.5 NA
D.31g白磷分子中所含共价键数为1.5NA
19、下列说法中正确的是 ( )
A.干冰升华时,分子内共价键会发生断裂
B.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
C.同一主族的元素的第一电离能,随着原子序数的递增而增大
D.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
18、X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能是1:1
D.X2Y可能是离子化合物,也可能是共价化合物
17、乙烷、乙烯、乙炔分子的共价键中σ键和π键的数目正确的是 ( )
A.6、1,4、2,2、3 B.7、0,5、1,3、2
C.7、0,4、2,2、3 D.7、0,5、1,2、3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com