
(9)函数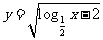 的定义域为 .
的定义域为 .
(10)若复数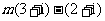 (其中
(其中 为虚数单位)在复平面内对应的点位于第四象限,则实数
为虚数单位)在复平面内对应的点位于第四象限,则实数 的取值范围为 .
的取值范围为 .
(11)甲、乙、丙三名射击运动员在某次测试中各射击20次,三人的测试成绩如下表
|
|
|
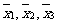 分别表示甲、乙、丙三名运动员的这次测试成绩的平均数,则
分别表示甲、乙、丙三名运动员的这次测试成绩的平均数,则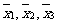 的大小关系是
;
的大小关系是
; 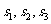 分别表示甲、乙、丙三名运动员的这次测试成绩的标准差,则
分别表示甲、乙、丙三名运动员的这次测试成绩的标准差,则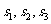 的大小关系是
.
的大小关系是
.
(12)向量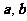 满足
满足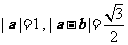 ,
,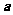 与
与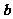 的夹角为
的夹角为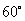 ,
,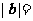 .
.
(13)若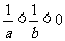 ,则下列不等式中,
,则下列不等式中,
①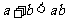 ②
②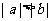 ③
③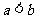 ④
④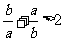
正确的不等式有 .(写出所有正确不等式的序号)
(14)已知圆的方程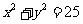 ,过
,过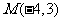 作直线
作直线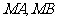 与圆交于点
与圆交于点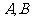 ,且
,且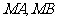 关于直线
关于直线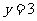 对称,则直线
对称,则直线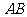 的斜率等于 .
的斜率等于 .
(1)已知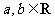 ,那么“
,那么“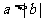 ”是“
”是“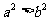 ”的
”的
(A)充分非必要条件 (B)必要非充分条件
(C)充分必要条件 (D)既非充分又非必要条件
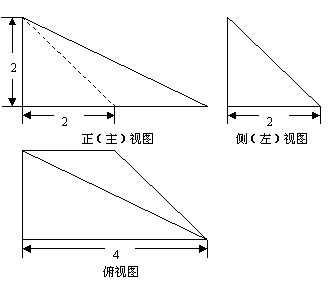 (2)一个几何体的三视图如图所示,则这个几何体的体积等于
(2)一个几何体的三视图如图所示,则这个几何体的体积等于
(A) 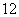 (B)
(B)  (C)
(C)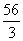 (D)
(D)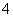
(3)设函数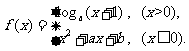 若
若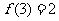 ,
, ,则
,则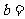
(A) 0
(B) 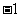 (C)1 (D)2
(C)1 (D)2
(4)把函数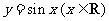 的图象上所有的点向左平移
的图象上所有的点向左平移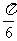 个单位长度,再把所得图象上所有点的横坐标伸长到原来的2倍(纵坐标不变),得到的图象所表示的函数为
个单位长度,再把所得图象上所有点的横坐标伸长到原来的2倍(纵坐标不变),得到的图象所表示的函数为
(A)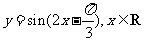 (B)
(B)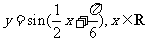
(C)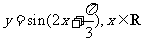 (D)
(D)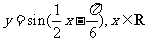
(5)已知椭圆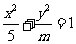 的离心率
的离心率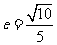 ,则
,则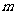 的值为
的值为
(A)3 (B) 或
或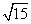 (C)
(C)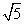 (D)
(D)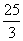 或3
或3
(6)将石子摆成如图的梯形形状.称数列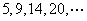 为“梯形数”.根据图形的构成,数列的第10项
为“梯形数”.根据图形的构成,数列的第10项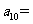



(A)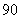 (B)
(B)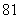 (C)
(C)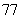 (D)
(D)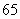
(7)已知命题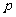 :对
:对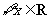 ,
,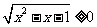 恒成立.命题
恒成立.命题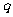 :
: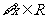 ,使
,使 成立.
成立.
则下列命题中为真命题的是
(A)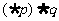 (B)
(B)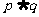 (C)
(C) (D)
(D)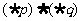
(8)设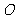 为坐标原点,
为坐标原点,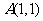 ,若点
,若点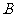 满足
满足 ,则
,则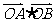 的最小值为
的最小值为
(A)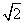 (B)2 (C)3 (D)
(B)2 (C)3 (D)
崇文区2009-2010学年度第二学期统一练习(二)
高三数学(文科) 2010.5
第Ⅱ卷(共110分)
34、(12分)X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为nsnnpn+1,Z是地壳内含量(质量分数)最高的元素,W的核电荷数是X与Z的核电荷数之和,N在元素周期表的各元素中电负性最大。
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是 ,在周期表中的位置是 ,其基态原子的电子排布式为 ,在形成化合物时它的最高化合价为
(3)Y的氢化物的VSEPR模型是 ,属于 分子(填极性或非极性),
(4)X的氢化物的沸点 Z的氢化物的沸点(填大于、小于或等于)
原因是
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
33、(10分)五种元素A、B、C、D、E位于元素周期表的前四周期,已知它们的核电荷数依次增加,A是宇宙中含量最多的元素;B原子的L层p轨道中有2个电子;C与B原子的价层电子数相同;D原子M层的d轨道有一个成对电子;E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)B与A形成只含一个中心原子的共价化合物,其分子的电子式为 ,中心原子的杂化轨道类型是 ,其分子的的立体构型是
(2)A的氧化物与B的氧化物中,分子极性较小的是(填分子式)__________
(3)B与C比较,电负性较大的(填元素名称)____________
(4)写出D的价层电子排布式
(5)E与Al的化学性质相似,请写出E与NaOH溶液反应的化学方程式
(6)写出D的最高价氧化物与盐酸反应的离子方程式
32、(9分)五种短周期元素A、B、C、D、E原子序数逐渐增大。A和B在同一周期,A是同周期元素中半径最大的(不包含稀有气体);B原子的次外层电子数是最外层电子数的4倍;C是同周期简单离子中半径最小的元素;D元素原子的p轨道有3个未成对电子;E原子的K、L层电子数之和比K、M层电子数之和多1个。
(1)写出E元素基态原子的外围电子排布式
(2)比较第一电离能的大小:B C(填大于、小于或等于)
(3)分别写出D、E的最高价氧化物对应水化物的化学式 、 ,并比较二者酸性(或碱性)的强弱 (填大于、小于或等于)
(4)写出B的最高价氧化物对应水化物与E的最高价氧化物对应水化物反应的离子方程式
(5)写出C的最高价氧化物对应水化物与A 的最高价氧化物对应水化物反应的化学方程式
的最高价氧化物对应水化物反应的化学方程式
31、(9分)请回答下列问题:
(1)写出铜元素基态原子的电子排布式 ,属于 区
(2)写出配合物K3[Fe (SCN)6]中的中心离子为 ,配体为
(3)PCl3分子的空间构型为 ,中心原子成键时采取的杂化轨道类型为
(4)向盛有硫酸铜水溶液的试管中逐滴加入氨水至过量,实验现象是 ,有关反应的离子方程式为
30、下列各组顺序,正确的是 ( )
A.微粒半径大小:S2- >Cl- >F- >Na+ >Al3+
B.热稳定性大小:SiH4>PH3>NH3>H2O
C.沸点高低:HF>H2O>NH3
D.等物质的量浓度溶液,酸性强弱顺序: H2SO4>H3PO4>H2SiO3>HNO2
II卷(非选择题40分)
29、下列说法正确的是 ( )
A.原子和其它原子形成共价键时,其共价键数一定等于该原子的价电子数
B.HS- 和HCl均是含有一个极性键的18电子粒子
C.铵根离子呈正四面体结构
D.离子化合物中只有离子键,共价化合物中只有共价键
28、因为镁、锂在元素周期表中具有特殊的“对角线”位置而性质相似,如它们的单质在过量氧气中燃烧均只生成正常氧化物等。以下叙述的锂的性质与镁相似,其中正确的是( )
A.Li2SO4难溶于水
B.LiOH是可溶于水,受热不分解的强碱
C.遇浓H2SO4不会产生“钝化现象”
D.Li2CO 3受热分解生成Li2O和CO2
3受热分解生成Li2O和CO2
27、短周期元素X、Y、Z、W在周期表 中的位置关系如图所示,下列叙述中正确的是( )
中的位置关系如图所示,下列叙述中正确的是( )
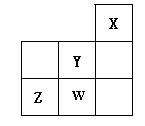 A.Y的氢化物稳定性大于Z的氢化物稳定性
A.Y的氢化物稳定性大于Z的氢化物稳定性
B.Y的氢化物的水溶液是一种强酸
C.1molW的单质跟足量的NaOH水溶 液反应时,
液反应时,
转移的电子数为1mol
D.X一定是活泼的非金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com