
1.(2009·广东,14)(1)在阳光照射下,充满雾气的瀑布上方常常会出现美丽的彩虹.彩虹是太阳光射入球形水珠经折射、内反射,再折射后形成的.光的折射发生在两种不同介质的________上,不同的单色光在同种均匀介质中________不同.
(2)如图2-1-13为声波干涉演示仪的原理图,两个U形管A和B套在一起,A管两侧各有一小孔.声波从左侧小孔传入管内,被分成___________的波.当声波分别通过A、B传播到右侧小孔时,若两列波传播的路程相差半个波长,则此处声波的振幅________;若传播的路程相差一个波长,则此处声波的振幅________.
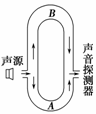
图2-1-13
解析:声波从左侧小孔传入管内,被分成两列频率相同的波且相位差固定.若波程相差为半波长的偶数倍,则干涉相长;若波程相差为半波长的奇数倍,则干涉相消.所以两列波传播的路程相差半个波长(奇数倍),则此处声波的振幅减小;若传播的路程相差一个波长(半波长的偶数倍),则此处声波的振幅增大.
答案:(1)界面 折射率 (2)相同 减小 增大
29.(2010四川理综卷)(16分)四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下
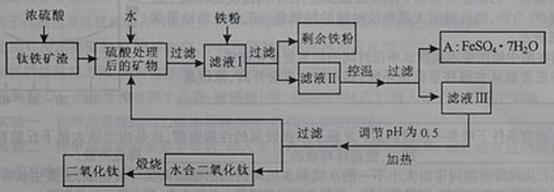
请回答下列问题:
硫酸与二氧化钛反应的化学方程式是____________________________________。
(1) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________。
(2) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
答案:(1) 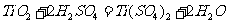 或
或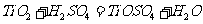
(2)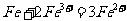
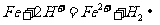
(3) 加水促进钛盐水解,加热促进钛盐水解,降低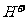 浓度促进钛盐水解
浓度促进钛盐水解
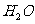
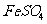
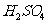
(4) 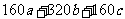
解析:本题属于化工生产流程题。(1)考查酸的通性,可以与金属氧化物反应,又知道TI的化合价,可以写出化学方程式。(2)加入浓硫酸后,浓硫酸可以氧化亚铁离子,再加入铁粉,铁粉可以还原铁离子。除此外,铁粉还可以与溶液中的H+反应、(3)考查了影响盐类水解的因素。(4)考虑最后溶质是只有硫酸钠和硫酸铁,根据开始加入A为2a×103mol加入适量氢氧化钠溶液恰好完全反应.,说明加入氢氧化钠的物质的量为4a×103mol,后来又加入12b×103mol的A,和2c×103mol的铁。根据电荷守恒,溶质中硫酸钠消耗硫酸根离子为2a×103mol,。而溶液中加入的硫酸根离子物质的量共计为(2a+12b)×103mol,这样剩下的硫酸根就与铁离子结合。可知消耗铁离子为8b×103mol,根据铁元素守恒。nFe=(2a+4b+2c) ×103mol,n Fe2O3=(a+2b+c) ×103mol,计算得mFe2O3=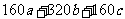 kg.
kg.
20.(2010江苏卷)(10分)以水氯镁石(主要成分为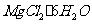 )为原料生产碱式碳酸镁的主要流程如下:
)为原料生产碱式碳酸镁的主要流程如下:


(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的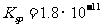 ,若溶液中
,若溶液中 ,则溶液中
,则溶液中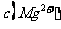 =
。
=
。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。
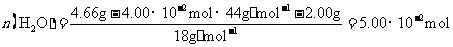
(3)高温煅烧碱式碳酸镁得到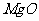 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下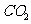 0.896L,通过计算确定碱式碳酸镁的化学式。
0.896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有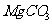 ,则产品中镁的质量分数 ▲ (填
“升高”、“降低”或“不变”)。
,则产品中镁的质量分数 ▲ (填
“升高”、“降低”或“不变”)。
[答案]
(1)2.0mol.L-1
(2)NH4Cl
(3)Mg(OH)24MgCO34H2O
(4)升高
[解析]本题主要考查的是有关Ksp的计算和无机化工流程和化学计算。(1)依据Ksp计算的公式可知c(Mg2+)=Ksp/c2(OH-)= 2.0mol/L;(2)通过流程分析,最后 综上分析可知,滤液中的主要成分为NH4Cl,浓缩以后得到的固体物质为NH4Cl;(3)根据题给相关物质的数据可有以下计算
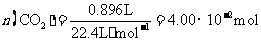
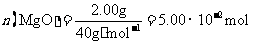
所以,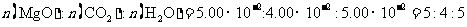 ,从而得到其化学组成为;Mg(OH)24MgCO34H2O
,从而得到其化学组成为;Mg(OH)24MgCO34H2O
(4)因为MgCO3中Mg的含量比碱式碳酸镁的含量高,因此,混有MgCO3后,Mg的含量升高。
18.(2010江苏卷)(12分)正极材料为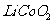 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型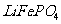 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过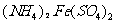 、
、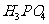 与
与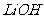 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将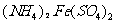 和
和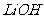 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向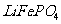 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的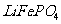 的导电性能外,还能
。
的导电性能外,还能
。
(2)废旧锂离子电池的正极材料试样(主要含有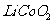 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
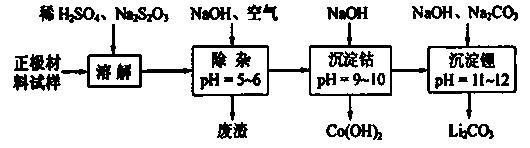
① 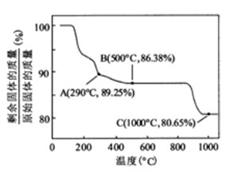 在上述溶解过程中,
在上述溶解过程中,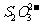 被氧化成
被氧化成 ,
,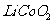 在溶解过程中反应的化学方程式为
。
在溶解过程中反应的化学方程式为
。
② 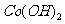 在空气中加热时,固体残留率随温度的变化
在空气中加热时,固体残留率随温度的变化
如右图所示。已知钴的氢氧化物加热至290℃时已完全
脱水,则1000℃时,剩余固体的成分为 。(填化学式);
在350~400℃范围内,剩余固体的成分为 。(填化学式)。
[答案]
(1)
①Fe2+在碱性条件下更易被氧化(凡合理答案均可)
②(NH4)2Fe(SO4)2+LiOH+H3PO4=LiFePO4+2NH4HSO4+H2O
③与空气中O2反应,防止LiFePO4中的Fe2+被氧化
(2)
①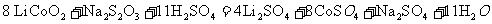
② 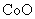
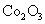 、
、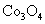
[解析]本题考察的知识比较散,涉及到能源利用,物质性质、化工流程分析,图表分析,覆盖面比较广。(1)①不能直接混合的原因是Fe2+在碱性条件下更容易被氧化;②根据题给的信息,发生的反应为(NH4)2Fe(SO4)2+LiOH+H3PO4=LiFePO4+2NH4HSO4+H2O③消耗空气中的O2,保护Fe2+,防止Fe2+被氧化;(2)①通过题给信息可知LiCoO2与Na2S2O3发生了氧化还原反应,反应为8 LiCoO2+ Na2S2O3+11H2SO4=4Li SO4+8CoSO4+ Na2SO4+11 H2O②根据质量的变化,在变化过程中,Co的质量没有变,通过题给数据看,在10000C是Co(OH)2完全分解,则产物CoO,在350-4000C时,固体的质量在89.25%-86.38%之间,可以通过极点进行分析,在2920C,n(Cr)n(O)=100/93:(89.25-100*59/93)/16=2:3,其化学式为Co2O3在5000C n(Cr)n(O)= 100/93:(86.38-100*59/93)/16=3:4其化学式为Co3O4 ,所以可以确定在350-4000C时的化学式为Co2O3和Co3O4
30.(2010上海卷)Na2SO3·7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na2SO3在30℃时的溶解度为35.5g/100gH2O。
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数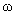 。(保留2位小数)
。(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量。
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3·7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度。
答案:1)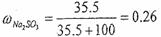 ;2)135.5:100=271:x;x=200(g);3)Na2SO3.7H2O中Na2SO3的质量分数为0.50,
;2)135.5:100=271:x;x=200(g);3)Na2SO3.7H2O中Na2SO3的质量分数为0.50,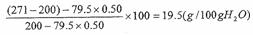 。
。
解析:此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识。1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g;溶剂为100g;溶液总质量为135.5g,则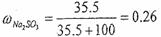 ;2)271g饱和溶液中,假设其含有的溶剂为x,则135.5:100=271:x;x=200(g);3)冷却溶液后,析出晶体79.5g,根据其晶体的组成,其中含有水和亚硫酸钠各一半,列式得:
;2)271g饱和溶液中,假设其含有的溶剂为x,则135.5:100=271:x;x=200(g);3)冷却溶液后,析出晶体79.5g,根据其晶体的组成,其中含有水和亚硫酸钠各一半,列式得: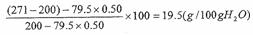 。
。
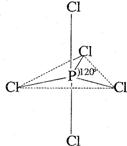 (2010上海卷)31.白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
(2010上海卷)31.白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
1)6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为 L。
上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为 mol·L-1。
2)含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为 。
3)白磷和氯、溴反应,生成混合卤化磷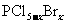 (
(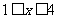 ,且x为整数)。
,且x为整数)。
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为 。
4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030mol磷腈化合物。推算磷腈化合物的相对分子质量(提示:M>300)。
答案:1)5.6;4.00;2)Ca5(PO4)3(OH);3)297.5或342;4)348或464。
解析:此题考查了元素化合物、化学计算知识。1)白磷燃烧生成五氧化二磷,白磷的相对分子质量为:128,则其6.20g的物质的量为:0.05mol,其完全燃烧消耗氧气0.25mol,标准状况下体积为5.6L;将这些白磷和水反应生成磷酸0.20mol,溶液体积为50mL,也就是0.05L,则磷酸溶液的物质的量浓度为4.00mol/L;2)根据该水溶液中含有溶质的物质的量和氢氧化钙悬浊液中溶质的物质的量,根据质量守恒,可知该物质中含有5个钙离子和3个磷酸根离子,结合电荷守恒,必还含有1个氢氧根离子,写作:Ca5(PO4)3(OH);3)根据题意x为整数,其可能为:PCl4Br、PCl3Br2、PCl2Br3、PClBr4四种,要是有三种不同结构的话,结合PCl5的结构,其可能为:PCl3Br2或PCl2Br3,则其相对分子质量可能为:297.5或342;4)根据题意和质量守恒定律,可求出化合物提供的Cl原子的物质的量为:0.1mol×5+0.1mol×1=0.6mol;由于磷腈化合物中只含有三种元素,故必须将其中的氢原子全部除去;两物质提供的H原子的物质的量为:0.1mol×4=0.4mol,则生成的氯化氢的物质的量为:0.1mol×4=0.4mol;则磷腈化合物中含有的Cl原子为:0.2mol、P原子为:0.1mol、N原子为:0.1mol,则该化合物的最简式为:PNCl2;假设其分子式为(PNCl2)x,由其含有的碳原子总数小于20,则知:4x<20,故x<5;假设x=4,其分子式为: P4N4Cl8,相对分子质量为464;假设x=3,其分子式为: P3N3Cl6,相对分子质量为:348;假设x=2,其分子式为:P2N2Cl4,相对分子质量<300 舍去。故其相对分子质量可能为:348或464。
25.(2010上海卷)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
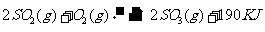
1)该反应所用的催化剂是 (填写化合物名称),该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是 .
a.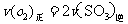 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20
mol SO2和0.10molSO2,半分钟后达到平衡,测得容器中含SO30.18mol,则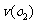 = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
答案:1)五氧化二钒(V2O5);大于;2)在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;3)bd;4)0.036;向正反应方向;0.36;0.40。
解析:此题考查了工业制硫酸、化学平衡常数、热化学方程式、化学平衡状态、有关化学平衡的计算等知识。1)工业制硫酸时二氧化硫催化氧化使用的催化剂是五氧化二钒;该反应正向放热,故温度越高化学平衡常数越小;2)热化学方程式表示的是450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;3)根据化学平衡状态的特征,容器中气体的平均相对分子质量不随时间变化、分子总数不随时间变化时,说明反应达到平衡状态;4)当达到平衡时,容器中SO3的物质的量为0.18mol,则v(SO3)=0.072mol.L-1.min-1,则v(O2)=0.036mol.L-1.min-1;再继续通入0.20molSO2和0.10molO2时,平衡向正反应方向移动,在此达到平衡时,SO3的物质的量介于0.36和0.40之间。
知识归纳:化学平衡常数只是和温度相关的函数,其随温度变化而变化。若正反应为吸热反应,温度升高K值增大;若正反应为放热反应,温度升高K值减小。
27.(2010安徽卷)(14分)锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiNB2O4的质量为18.1 g第③步反应中加入20.0mL3.0mol·L-1的H2SO4溶液。定正极材料中的锂经反应③和④完全为Li2CO3,剩至少有 Na2CO3参加了反应。
答案:(1)Al(OH)3
(2)4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O
(3) 漏斗 玻璃棒 烧杯 ; 滤纸破损、滤液超过滤纸边缘等
(4)5.3
解析:第一步就是铝溶解在氢氧化钠溶液中 第二步就是偏铝酸钠与二氧化碳生成氢氧化铝,第三步是氧化还原反应,注意根据第一步反应LiMn2O4不溶于水。
第(4)小题计算时要通过计算判断出硫酸过量。
28.(2010山东卷)(14分)硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO42===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中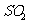 氧化性比HI强
氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均放映速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
解析:(1)H2SO4在常温下,很稳定不易分解,这是常识,故a错;反应Ⅰ中SO2是还原剂,HI是还原产物,故还原性SO2>HI,则b错;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O==2H2+O2,故c正确d错误。
(2) υ (H2)=0. 1mol/1L/2min=0.05 mol·L-1·min-1,则υ (HI)=2 υ (H2)=0.1 mol·L-1·min-1;
2HI(g)==H2(g)+I2(g)
2 1 1
起始浓度/mol·L-1 1 0 0
变化浓度/mol·L-1: 0.2 0.1 0.1
平衡浓度/mol·L-1: 0.8 0.1 0.1
则H2(g)+I2(g)==
2HI(g)的平衡常数K=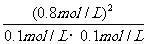 =64mol/L。
=64mol/L。
若开始时加入HI的量是原来的2倍,则建立的平衡状态和原平衡是等比平衡,HI、H2、I2 的物质的量、平衡浓度都是原来的两倍;各组分的百分含量、体积分数相等,平衡常数相等(因为温度不变);因开始时的浓度增大了,反应速率加快,达平衡时间不可能是原来的两倍,故选b.
(3)水的电离平衡为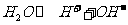 ,硫酸电离出的
,硫酸电离出的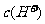 对水的电离是抑制作用,当
对水的电离是抑制作用,当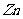 消耗了
消耗了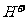 ,
,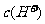 减小,水的电离平衡向右移动;若加入
减小,水的电离平衡向右移动;若加入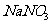 ,溶液变成
,溶液变成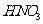 的溶液了,不再生成H2;加入的
的溶液了,不再生成H2;加入的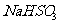 会和
会和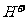 反应,降低
反应,降低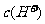 ,反应速率减慢;
,反应速率减慢;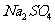 的加入对反应速率无影响;加入CuSO4 后,
的加入对反应速率无影响;加入CuSO4 后,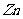 与置换出的Cu构成原电池,加快了反应速率,选b.
与置换出的Cu构成原电池,加快了反应速率,选b.
(4)根据反应方程式,生成1mol水时放出热量为:572kJ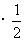 =286 kJ,故该电池的能量转化率为
=286 kJ,故该电池的能量转化率为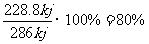
答案:(1)c
(2)0.1 mol·L-1·min-1 ;64mol/L;b
(3)向右;b
(4)80%
31.(2010广东理综卷)(16分)硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3
+3H2O中,H3BO 3的转化率(
B(OCH3)3
+3H2O中,H3BO 3的转化率( )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
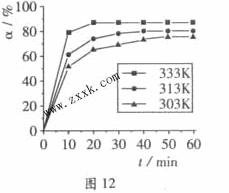
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的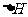 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.
0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.
0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
解析:(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
(2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。
(3) K=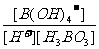 =
=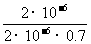 =
=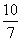
答案:
(1) B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O
(3) 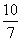 或1.43
或1.43
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com